中华人民共和国农业农村部公告 第158号
根据《兽药管理条例》和《兽药注册办法》规定,经审查,批准华东理工大学等27家单位申报的大菱鲆鳗弧菌基因工程活疫苗(MVAV6203株)等10种兽药产品为新兽药,核发《新兽药注册证书》,发布产品试行规程、质量标准、说明书和标签,自发布之日起执行。
特此公告。
附件:1.新兽药注册目录
2.试行规程
3.质量标准
4.说明书和标签
5.泰地罗新最高残留限量(试行)和残留检测方法标准(试行)
农业农村部
2019年4月4日
附件1
新兽药注册目录
|
新兽药名称 |
研制单位 |
类别 |
新兽药注 册证书号 |
监测期 |
备注 |
|
大菱鲆鳗弧菌基因工程活疫苗(MVAV6203株) |
华东理工大学、上海浩思海洋生物科技有限公司 |
一类 |
(2019)新兽药 证字15号 |
5年 |
注册 |
|
头孢洛宁 |
中国农业科学院饲料研究所、齐鲁晟华制药有限公司、齐鲁动物保健品有限公司、北京市畜牧总站 |
二类 |
(2019)新兽药 证字16号 |
4年 |
注册 |
|
头孢洛宁乳房注入剂(干乳期) |
中国农业科学院饲料研究所、齐鲁动物保健品有限公司、北京市畜牧总站、齐鲁晟华制药有限公司 |
二类 |
(2019)新兽药 证字17号 |
4年 |
注册 |
|
泰地罗新 |
齐鲁晟华制药有限公司、齐鲁动物保健品有限公司、中国农业大学 |
二类 |
(2019)新兽药 证字18号 |
4年 |
注册 |
|
泰地罗新注射液 |
齐鲁动物保健品有限公司、齐鲁晟华制药有限公司、中国农业大学 |
二类 |
(2019)新兽药 证字19号 |
4年 |
注册 |
|
头孢洛宁 |
中牧实业股份有限公司、中国牧工商集团有限公司、艾美科健(中国)生物医药有限公司、山东鲁抗舍里乐药业有限公司、湖北中牧安达药业有限公司、扬州大学 |
二类 |
(2019)新兽药 证字20号 |
4年 |
注册 |
|
头孢洛宁乳房注入剂(干乳期) |
中牧实业股份有限公司、中国牧工商集团有限公司、山东鲁抗舍里乐药业有限公司高新区分公司、艾美科健(中国)生物医药有限公司、中牧全药(南京)动物药品有限公司、扬州大学 |
二类 |
(2019)新兽药 证字21号 |
4年 |
注册 |
|
银黄二陈合剂 |
保定冀中药业有限公司、山东派森药业有限公司、保定冀中生物科技有限公司、保定阳光本草药业有限公司、河北农业大学 |
三类 |
(2019)新兽药 证字22号 |
3年 |
注册 |
|
柴黄口服液 |
河北远征药业有限公司、河北锦坤动物药业有限公司、郑州福源动物药业有限公司、河北远征禾木药业有限公司、石家庄石牧动物药业有限公司、河北好施德生物科技有限公司、河北农业大学 |
三类 |
(2019)新兽药 证字23号 |
3年 |
注册 |
|
碘甘油混合溶液 |
中国农业科学院饲料研究所、利拉伐(天津)有限公司 |
三类 |
(2019)新兽药 证字24号 |
3年 |
注册 |
附件2(略)
附件3(略)
附件4
大菱鲆鳗弧菌基因工程活疫苗(MVAV6203株)等10种兽药产品说明书和标签
一、大菱鲆鳗弧菌基因工程活疫苗(MVAV6203株)说明书和内包装标签
(一)大菱鲆鳗弧菌基因工程活疫苗(MVAV6203株)说明书
兽用
【兽药名称】
通用名:大菱鲆鳗弧菌基因工程活疫苗(MVAV6203株)
商品名:无
英文名:Turbot Vibrio angnillarum Genetic Engineering Vaccine, Live (Strain MVAV6203)
汉语拼音:Dalingping Manhujun Huoyimiao(MVAV6203 Zhu)
【主要成分与含量】 本品含鳗弧菌MVAV6203减毒菌。每尾份含活菌数不少于1.0 × 106.0 CFU。
【性状】 疏松团块,易与瓶壁脱离,加疫苗稀释液或无菌生理盐水后迅速溶解。
【作用与用途】 预防由O1血清型鳗弧菌导致的大菱鲆弧菌病。免疫期为3个月。
【用法与用量】 按照瓶签注明尾份,用疫苗稀释液或无菌生理盐水将疫苗稀释成10尾份/ml,对4~5月龄健康大菱鲆每尾腹腔注射疫苗溶液0.1 ml,免疫结束后正常养殖。
【不良反应】 一般无可见的不良反应。
【注意事项】(1)仅用于接种健康大菱鲆;
(2)免疫接种前后10日内不可使用抗菌素;
(3)免疫前48小时禁食;
(4)用过的疫苗瓶、器具、未用完的疫苗等应进行消毒。
【规格】 (1)1000尾份/瓶 (2)2000尾份/瓶 (3)5000尾份/瓶
【包装】 10瓶/盒
【贮藏与有效期】 -15℃以下保存,有效期为15个月。
【批准文号】
【生产企业】
仅在兽医指导下使用
(二)大菱鲆鳗弧菌基因工程活疫苗(MVAV6203株)内包装标签
大菱鲆鳗弧菌基因工程活疫苗(MVAV6203株)
兽用
1000(2000、5000)尾份/瓶 批准文号:
批 号:
有效期至:
详见说明书。
【作用与用途】 预防由O1血清型鳗弧菌导致的大菱鲆弧菌病。免疫期为3个月。
【用法与用量】 详见说明书。
【贮藏与有效期】 -15℃以下保存,有效期为15个月。
【生产企业】
仅在兽医指导下使用
二、头孢洛宁标签
兽用
【兽药名称】
通用名称:头孢洛宁
英文名称:Cefalonium
汉语拼音:Toubaoluoning
【包装规格】
【生产日期】
【生产批号】
【有效期】至
【运输注意事项】 轻搬轻放,切勿挤压。
【贮藏】 密封,25℃以下保存。
【批准文号】
【生产企业】
三、头孢洛宁乳房注入剂(干乳期)说明书和标签
(一)头孢洛宁乳房注入剂(干乳期)说明书
兽用
【兽药名称】
通用名称:头孢洛宁乳房注入剂(干乳期)
商品名称:
英文名称:Cefalonium Intramammary Infusion(Dry Cow)
汉语拼音:Toubaoluoning Rufang Zhuruji(Ganruqi)
【主要成分】 头孢洛宁
【性状】 本品为类白色至淡黄色混悬液体。
【药理作用】 β-内酰胺类抗生素。头孢洛宁为第一代动物专用的头孢菌素类抗生素。其主要通过与细菌胞质膜上的青霉素结合蛋白(PBPs)结合,造成敏感菌内黏肽的交叉联结受到阻碍,细胞壁缺损,从而使细菌裂解死亡。头孢洛宁对金黄色葡萄球菌、无乳链球菌、乳房链球菌和大肠杆菌等细菌有良好的抗菌活性。
【适应证】 用于治疗由金黄色葡萄球菌、无乳链球菌、乳房链球菌和大肠杆菌等细菌引起的奶牛干乳期乳房炎以及预防干乳期奶牛乳房内新增感染。
【用法与用量】 以本品计。乳管注入:干乳期奶牛,每个乳室1支。
在最后一次挤奶后,排空乳房,并清洗和消毒乳头。取下注射器头部的顶盖,将注射器头部插入乳管,轻轻地推动注射器活塞直到药液都挤进乳管内。注入药液后,双手按摩乳房使药物在乳房中均匀分布,并用批准用于乳头消毒的消毒剂给乳头药浴。
【不良反应】 按推荐剂量使用,暂未见不良反应。
【注意事项】 1.用于奶牛干乳期乳房炎,禁用于泌乳期奶牛。
2.禁用于对β-内酰胺类抗生素过敏的动物。
3.对此类药物有过敏反应者请避免直接接触此产品。
4.使用前将药液摇匀。
5.用过的注射器不可再用。
6.给药后30日内禁止屠宰食用动物的肉类和内脏。
7.置于儿童不可触及处。
【弃奶期】 若给药后54日之后产犊,则弃奶期为产犊后96小时;若给药后54日之内产犊,则弃奶期为给药后54日加96小时。
【规格】 按C20H18N4O5S2计 3g:0.25g
【包装】 3g /支
【贮藏】 密闭,在30℃以下保存,禁止冷冻。
【有效期】 24个月。
【批准文号】
【生产企业】
(二)头孢洛宁乳房注入剂(干乳期)标签
【兽药名称】
通用名称:头孢洛宁乳房注入剂(干乳期)
商品名称:
英文名称:Cefalonium Intramammary Infusion(Dry Cow)
汉语拼音:Toubaoluoning Rufang Zhuruji(Ganruqi)
【主要成分】 头孢洛宁
【性状】 本品为类白色至淡黄色混悬液体。
【适应证】 用于治疗由金黄色葡萄球菌、无乳链球菌、乳房链球菌和大肠杆菌等细菌引起的奶牛干乳期乳房炎以及预防干乳期奶牛乳房内新增感染。
【用法与用量】 以本品计。乳管注入:干乳期奶牛,每个乳室1支。
在最后一次挤奶后,排空乳房,并清洗和消毒乳头。取下注射器头部的顶盖,将注射器头部插入乳管,轻轻地推动注射器活塞直到药液都挤进乳管内。注入药液后,双手按摩乳房使药物在乳房中均匀分布,并用批准用于乳头消毒的消毒剂给乳头药浴。
【规格】 按C20H18N4O5S2 计 3g:0.25g
【批准文号】
【生产日期】
【生产批号】
【有效期】至
【弃奶期】 若给药后54日之后产犊,则弃奶期为产犊后96小时;若给药后54日之内产犊,则弃奶期为给药后54日加96小时。
【包装】 3g/支
【贮藏】 密闭,在30℃以下保存,禁止冷冻。
【生产企业】
四、泰地罗新标签
兽用
【兽药名称】
通用名称:泰地罗新
英文名称:Tildipirosin
汉语拼音:Taidiluoxin
【包装规格】
【生产日期】
【生产批号】
【有效期】至
【运输注意事项】 轻搬轻放,切勿挤压。
【贮藏】 遮光,密封,在冷处保存。
【批准文号】
【生产企业】
五、泰地罗新注射液说明书和标签
(一)泰地罗新注射液说明书
兽用
【兽药名称】
通用名称:泰地罗新注射液
商品名称:
英文名称:Tildipirosin Injection
汉语拼音:Taidiluoxin Zhusheye
【主要成分】 泰地罗新
【性状】 本品为几乎无色至淡黄色液体。
【药理作用】 药效学 大环内酯类抗生素。泰地罗新为16元环的半合成大环内酯类抗生素。其主要通过与细菌核糖体50S亚基结合,阻止多肽链延长,抑制细菌蛋白质的合成。泰地罗新对猪胸膜肺炎放线杆菌、多杀性巴氏杆菌、副猪嗜血杆菌和支气管败血波氏杆菌有良好的抗菌活性。
药动学 猪每1kg体重肌内注射泰地罗新4mg,吸收迅速,达峰时间(tmax)为0.167h,峰浓度(Cmax)为1.116µg/ml,绝对生物利用度为82.58%。体内分布广泛,表观分布容积(Vd)为60.998L•kg-1,肺和支气管液中泰地罗新的浓度较高。消除半衰期(t1/2)长,约为121.90h。药物约17%通过尿液排出,约57%通过粪便排出。
【适应证】 用于治疗和控制对泰地罗新敏感的胸膜肺炎放线杆菌、多杀性巴氏杆菌和副猪嗜血杆菌等细菌引起的猪呼吸系统疾病。
【用法与用量】 以泰地罗新计。肌内注射:一次量,每1kg体重,猪4mg,仅用一次。
【不良反应】1.肌内注射后,注射部位可能会出现短暂的肿胀,并偶尔伴有轻微疼痛。
2.极少数情况下(发生率小于1/10000),仔猪出现短暂的昏迷,个体动物发生休克甚至死亡。
3.按照最大注射体积(5ml)给药通常会引起注射部位轻微肿胀,触诊无疼痛。肿胀持续3日,注射部位反应在21日之内完全消失。
【注意事项】1.禁用于对大环内酯类抗生素或其辅料过敏的动物。
2.禁与其他大环内酯类、林可酰胺类或链阳霉素类抗生素同时使用。
3.对于妊娠期和泌乳期的动物,应在兽医指导下使用。
4.禁止静脉注射。
6.每个注射部位的给药体积不超过5ml。
7.泰地罗新可能会引起皮肤过敏,如不慎接触,应立即用肥皂和清水清洗。如眼睛不慎接触,应立即用清水冲洗。
8.应避免出现自我注射的情况。一旦发生,立即就医并向医生提供产品说明书。
9.给药后洗手。
10.置于儿童不可触及处。
【休药期】 猪11日。
【规格】 按C41H71N3O8计(1)50ml:2g(2)100ml:4g
【包装】 (1)50ml/瓶 (2)100ml/瓶
【贮藏】 遮光,密闭,25℃以下保存。
【有效期】 24个月;开启后28日。
【批准文号】
【生产企业】
(二)泰地罗新注射液标签
兽用
【兽药名称】
通用名称:泰地罗新注射液
商品名称:
英文名称:Tildipirosin Injection
汉语拼音:Taidiluoxin Zhusheye
【主要成分】 泰地罗新
【性状】 本品为几乎无色至淡黄色液体。
【适应证】 用于治疗和控制对泰地罗新敏感的胸膜肺炎放线杆菌、多杀性巴氏杆菌和副猪嗜血杆菌等细菌引起的猪呼吸系统疾病。
【用法与用量】 以泰地罗新计。肌内注射:一次量,每1kg体重,猪4mg,仅用一次。
【规格】 按C41H71N3O8计(1)50ml:2g (2)100ml:4g
【批准文号】
【生产日期】
【生产批号】
【有效期】至
【休药期】 猪11日。
【贮藏】 遮光,密闭,25℃以下保存。
【包装】 (1)50ml/瓶 (2)100ml/瓶
【生产企业】
六、头孢洛宁标签
兽用
【兽药名称】
通用名称:头孢洛宁
英文名称:Cefalonium
汉语拼音:Toubaoluoning
【包装规格】
【生产日期】
【生产批号】
【有效期】 24个月。
【运输注意事项】 防潮,避光。
【贮藏】 遮光,密封,30℃以下干燥处保存。
【批准文号】
【生产企业】
七、头孢洛宁乳房注入剂(干乳期)说明书和标签
(一)头孢洛宁乳房注入剂(干乳期)说明书
兽用
【兽药名称】
通用名称:头孢洛宁乳房注入剂(干乳期)
商品名称:
英文名称:Cefalonium Intramammary Infusion (Dry Cow)
汉语拼音:Toubaoluoning Rufang Zhuruji (Ganruqi)
【主要成分】 头孢洛宁
【性状】 本品为类白色至淡黄色油混悬液;放置后分层,振摇后能均匀分散。
【药理作用】 β-内酰胺类抗生素。主要通过抑制细胞壁的合成达到杀菌的效果,具有广谱的抗菌活性,对青霉素酶稳定。体外抑菌试验表明对常见的革兰氏阴性菌和革兰氏阳性菌,包括金黄色葡萄球菌、凝固酶阴性葡萄球菌、乳房链球菌、无乳链球菌、停乳链球菌、棒状杆菌和大肠杆菌具有抑制作用。
【适应证】 用于治疗由金黄色葡萄球菌、无乳链球菌等敏感菌引起的奶牛干乳期乳房炎以及预防干乳期奶牛乳房内新增感染。
【用法与用量】 以本品计。乳管注入:干乳期奶牛,每个乳室1支。
给药前先用温热、适宜的消毒剂溶液彻底清洗乳头。待乳头完全晾干后,用力挤出乳房中的剩余乳汁。然后,清洗和消毒乳头及其边缘,将注射器插入乳管,轻轻的持续的将药物推入乳室。最后,按摩乳区以便药物均匀分散至乳腺的乳池内。
【不良反应】 按推荐剂量使用,未见不良反应。
【注意事项】
1. 仅用于干乳期奶牛。
2. 使用前将药液摇匀。
3. 不宜冷冻。
4. 给药后30日内禁止屠宰食用肉类和内脏。
5. 对β-内酰胺类抗生素过敏者勿接触本品。
6. 置儿童无法触及处。
【弃奶期】 若给药后54日之后产犊,则弃奶期为产犊后96小时;若给药后54日之内产犊,则弃奶期为给药后54日加96小时。
【规格】 按C20H18N4O5S2计3g:250mg
【包装】
【贮藏】 密封贮藏。
【有效期】 24个月。
【批准文号】
【生产企业】
(二)头孢洛宁乳房注入剂(干乳期)标签
兽用
【兽药名称】
通用名称:头孢洛宁乳房注入剂(干乳期)
商品名称:
英文名称:Cefalonium Intramammary Infusion (Dry Cow)
汉语拼音:Toubaoluoning Rufang Zhuruji (Ganruqi)
【主要成分】 头孢洛宁
【性状】 本品为类白色至淡黄色油混悬液;放置后分层,振摇后能均匀分散。
【适应证】 用于治疗由金黄色葡萄球菌、无乳链球菌等敏感菌引起的奶牛干乳期乳房炎以及预防干乳期奶牛乳房内新增感染。
【用法与用量】 以本品计。乳管注入:干乳期奶牛,每个乳室1支。
【规格】 按C20H18N4O5S2计 3g:250mg
【批准文号】
【生产日期】
【生产批号】
【有效期】至
【弃奶期】 若给药后54日之后产犊,则弃奶期为产犊后96小时;若给药后54日之内产犊,则弃奶期为给药后54日加96小时。
【包装】
【贮藏】 密封贮藏。
【生产企业】
八、银黄二陈合剂说明书和标签
(一)银黄二陈合剂说明书
兽用
【兽药名称】
通用名称:银黄二陈合剂
商品名称:
汉语拼音:Yinhuang Erchen Heji
【主要成分】 黄芩、金银花、姜半夏、陈皮、茯苓等。
【性状】 本品为红棕色液体,久置后有少量沉淀;味甘,微苦。
【功能与主治】 清热解毒,燥湿化痰。主治温热咳嗽,鸡传染性喉气管炎见上述证候者。
【用法与用量】 混饮:每1L水,鸡2ml,连用5日。
【不良反应】 按规定剂量使用,暂未发现不良反应。
【注意事项】
【规格】 每1ml相当于原生药1g。
【包装】 100ml/瓶。
【贮藏】 密封,置阴凉处。
【有效期】 24个月。
【批准文号】
【生产企业】
(二)银黄二陈合剂标签
兽用
【兽药名称】
通用名称:银黄二陈合剂
商品名称:
汉语拼音:Yinhuang Erchen Heji
【主要成分】 黄芩、金银花、姜半夏、陈皮、茯苓等。
【性状】 本品为红棕色液体,久置后有少量沉淀;味甘,微苦。
【功能与主治】 清热解毒,燥湿化痰。主治温热咳嗽,鸡传染性喉气管炎见上述证候者。
【用法与用量】 混饮:每1L水,鸡2ml,连用5日。
【规格】 每1ml相当于原生药1g。
【批准文号】
【生产日期】
【生产批号】
【有效期】至
【贮藏】 密封,置阴凉处。
【包装】 100ml/瓶。
【生产企业】
九、柴黄口服液说明书和标签
(一)柴黄口服液说明书
兽用
【兽药名称】
通用名称:柴黄口服液
商品名称:
汉语拼音:Chaihuang Koufuye
【主要成分】 北柴胡、黄芩。
【性状】 本品为红棕色的液体;味辛、微苦。
【功能与主治】 清热燥湿。预防高温、高湿引起的鸡体温升高,精神不振和食少。
【用法与用量】 混饮:每1L水,鸡1ml,高温、高湿期间添加。
【不良反应】 按规定剂量使用,暂未发现不良反应。
【注意事项】 在兽医指导下使用。
【规格】 每1ml相当于原生药1g。
【包装】 100ml/瓶。
【贮藏】 密封,置阴凉处。
【有效期】 24个月。
【批准文号】
【生产企业】
(二)柴黄口服液标签
兽用
【兽药名称】
通用名称:柴黄口服液
商品名称:
汉语拼音:Chaihuang Koufuye
【主要成分】 北柴胡、黄芩。
【性状】 本品为红棕色的液体;味辛、微苦。
【功能与主治】 清热燥湿。预防高温、高湿引起的鸡体温升高,精神不振和食少。
【用法与用量】 混饮:每1L水,鸡1ml,高温、高湿期间添加。
【规格】 每1ml相当于原生药1g。
【批准文号】
【生产日期】
【生产批号】
【有效期】至
【贮藏】 密封,置阴凉处。
【包装】 100ml/瓶。
【生产企业】
十、碘甘油混合溶液说明书和标签(二合一)
兽用外用
【兽药名称】
通用名称:碘甘油混合溶液
商品名称:
英文名称:Iodine Glycerol Mixed Solution
汉语拼音:Dian Ganyou Hunhe Rongye
【主要成分】 碘
【性状】 本品为红棕色至黑褐色液体;粘稠,具有碘的特臭。
【药理作用】 消毒防腐药。碘具有强大的消毒作用,主要以分子(I2)形式发挥作用,其原理可能是碘化和氧化病原微生物蛋白活性基团,并与蛋白的氨基酸结合而导致蛋白变性或抑制病原微生物的代谢酶系统。本品对引起奶牛乳房炎的病原体如金黄色葡萄球菌、无乳链球菌等细菌有较强的杀灭作用,有助于预防奶牛乳房炎病原微生物感染。
【用途】 用于泌乳期奶牛的乳头消毒。
【用法与用量】 外用。挤完奶后,立即使用本品原液浸渍或喷雾每个乳头,确保药液覆盖至少四分之三的乳头。
【不良反应】 按推荐的用法用量使用,未见不良反应。
【注意事项】 1.仅限外用。
2.禁与其他化学物质混合使用。
3.如果产品冻结,使用前应置于室温环境里解冻并充分摇匀。
4.开封使用后应原容器贮存并将盖拧紧。
5.气候寒冷有风时,药浴后,待乳头干燥后再释放奶牛。
6.对碘过敏者操作时应戴手套和防护面具。
7.避免接触人眼,一旦溅入人眼应立即用清水冲洗15分钟以上,必要时就医。
8.如果不慎吞食本品,应立即用清水清洁口腔,然后喝大量水,如症状持续,就医。
9.置于儿童无法触及处。
【弃奶期】 不需要制定。
【规格】 1.0%
【包装】 6L、20L、60L、200L
【贮藏】 遮光,密封保存。
【有效期】 24个月。
【生产日期】
【生产批号】
【批准文号】
【生产企业】
附件5
泰地罗新最高残留限量(试行)和残留检测方法标准(试行)
《动物性食品中兽药最高残留限量》(农业部公告第235号)无泰地罗新的每日允许摄入量(ADI)。申报单位参照国际食品法典委员会(CAC)和欧盟的有关标准,制定了泰地罗新的ADI和在猪组织中的最高残留限量(MRLs),具体数据见表1。
表1 泰地罗新的ADI及在猪组织中的MRLs信息表
|
活性成分 |
ADI |
残留标示物 |
靶动物 |
靶组织 |
MRLs |
|
泰地罗新 |
0~100μg/(kg b.w.) |
泰地罗新 |
猪 |
肌肉 皮肤+脂肪 肝脏 肾脏 |
1200μg﹒kg-1 800μg﹒kg-1 5000μg﹒kg-1 10000μg﹒kg-1 |
动物性食品中泰地罗新残留检测 液相色谱-串联质谱法(试行)
1. 范围
本标准规定了猪组织中泰地罗新残留检测的制样和液相色谱-串联质谱测定方法。
本标准适用于猪肌肉、皮肤+脂肪、肝脏、肾脏中泰地罗新残留量的检测。
2. 规范性引用文件
下列文件对于本文件的应用是必不可少的,凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1.1-2009 标准化工作导则第1部分:标准的结构和编写规则。
GB/T 6682 分析实验室用水规格和试验方法。
3. 原理
试料中的泰地罗新残留物用5%氨化乙腈的甲醇提取后,经中性氧化铝萃取柱净化,5%氨化乙腈的甲醇溶液洗脱,40℃水浴中旋转蒸发至近干,0.1%甲酸溶液:乙腈=95:5溶解,用液相色谱-串联质谱法检测,外标法定量。
4. 试剂和材料
以下所用的试剂,除特别注明外均为分析纯试剂;水为符合GB/T 6682规定的一级水。
4.1 泰地罗新对照品:含量98.1%。
4.2 中性氧化铝萃取柱 1000mg/6ml。
4.3 甲醇 色谱纯。
4.4 甲酸 色谱纯。
4.5 乙腈 色谱纯。
4.6 异丙醇。
4.7 正己烷。
4.8 浓氨溶液。
4.9 0.1%甲酸溶液:取甲酸0.5ml,用水稀释至500ml,混匀即得。
4.10 乙腈甲醇混合溶液(70:30;v/v):移取70ml乙腈和30ml甲醇,混匀即得。
4.11 5%氨化乙腈的甲醇溶液:移取5ml浓氨溶液和95ml乙腈甲醇混合溶液(70:30;v/v)中,混匀即得。
4.12 0.1%甲酸溶液:乙腈(95:5):即定容液,取95ml 0.1%甲酸溶液和5ml乙腈,混匀即得。
4.13 乙腈饱和正己烷溶液:将乙腈和正己烷按1:1比例混匀,吸取上层液体即得。
4.14 2mg/ml泰地罗新储备液:精确称取泰地罗新对照品20mg,用乙腈溶于10ml容量瓶中,涡旋使充分溶解,混匀,采用0.1%甲酸溶液:乙腈(95:5)配制成浓度为2mg/ml的泰地罗新储备液。-20℃冰箱中保存,有效期1个月。
4.15 20μg/ml泰地罗新标准工作液:准确量取100µl标准储备液于10ml容量瓶中,用0.1%甲酸溶液:乙腈(95:5)稀释、定容,制成20μg/ml的泰地罗新标准工作液。现用现配。
5. 仪器和设备
5.1 液相色谱-串联质谱仪(质谱配电喷雾离子源ESI)。
5.2 电子天平:感量0.0001g。
5.3 涡旋振荡器。
5.4 匀浆机。
5.5 高速离心机。
5.6 梨形瓶。
5.7 超声仪。
5.8 旋转蒸发仪。
6. 试料的制备与保存
6.1 试料的制备
取适量新鲜或解冻的空白或供试组织,绞碎,并使均质。
试料的制备包括:
——取均质后的供试样品,作为供试试料。
——取均质后的空白样品,作为空白试料。
——取均质后的空白样品,添加适量的标准工作液,作为空白添加试料。
6.2 试料的保存
-20℃以下保存。
7. 测定步骤
7.1 提取
称取试料2g±0.01g于50ml塑料离心管中,加入10ml 5%氨化乙腈的甲醇溶液,涡旋1min,超声15min,震荡25min,8000r/min离心10min,取上清液转移至另一离心管中,样品残渣再加入5ml 5%氨化乙腈的甲醇溶液重复提取一次,合并两次上清液作为提取液。
7.2 净化
中性氧化铝萃取柱用5ml乙腈活化,取提取液过柱,收集流出液(即上样液)后,再用6ml 5%氨化乙腈的甲醇溶液分3次洗脱,每次2ml,收集洗脱液,合并上样液和洗脱液于梨形瓶中,加入6ml异丙醇。在40℃水浴中旋转蒸发至近干,准确加入5ml定容液(见4.12)溶解残渣,涡旋,超声5min,再加5ml乙腈饱和正己烷,涡旋除脂,溶液转移至10ml塑料离心管中,静置,弃去正己烷层,10000r/min离心10min,取下层清液过0.22μm滤膜,作为试料溶液,供液相色谱-串联质谱测定。
7.3 基质匹配标准曲线的制备
取空白试料,按7.1~7.2操作步骤,制备用于配置系列基质标准工作溶液的空白基质提取液。
精密量取标准工作液适量,用空白基质提取液稀释成系列药物浓度为100µg/kg、200µg/kg、400µg/kg、800µg/kg和1000µg/kg的基质匹配标准工作液,对应上机浓度为40ng/ml、80ng/ml、160ng/ml、320ng/ml和400ng/ml。超出线性范围的试料溶液,上样前稀释至该范围内。
以泰地罗新特征离子质量色谱峰面积为纵坐标,基质匹配标准溶液浓度为横坐标(以上机浓度表示,单位为ng/ml),绘制标准曲线。计算回归方程和相关系数,要求标准曲线的相关系数 r≥0.99。
7.4 测定
7.4.1 液相色谱参考条件
色谱柱:BEH C18 2.1mm×50mm,粒径1.7μm,或相当者。
流动相:A相为0.1%甲酸溶液;B相为乙腈,梯度洗脱,洗脱条件见表1。
流速:0.3ml/min。
柱温:30℃。
进样量:5µl。
表1 梯度洗脱条件
|
时间(min) |
流动相A(%) |
流动相B(%) |
|
0.2 |
95 |
5 |
|
2.5 |
30 |
70 |
|
2.7 |
30 |
70 |
|
4.2 |
30 |
70 |
|
5 |
95 |
5 |
7.4.2 质谱条件
离子源:电喷雾离子源。
扫描方式:正离子扫描。
检测方式:多反应监测。
离子源温度:110℃。
脱溶剂温度:400℃。
毛细管电压:3.2kV。
脱溶剂气流速:700L/h。
泰地罗新定性、定量离子对及对应锥孔电压、碰撞能量参考值见表2。
表2 泰地罗新质谱参数
|
药物 |
定量离子对(m/z) |
定性离子对(m/z) |
锥孔电压(V) |
碰撞能量(eV) |
|
泰地罗新 |
735.4>98.0 |
735.4>98.0 |
30 |
35 |
|
735.4>174.2 |
30 |
40 |
7.4.3 测定法
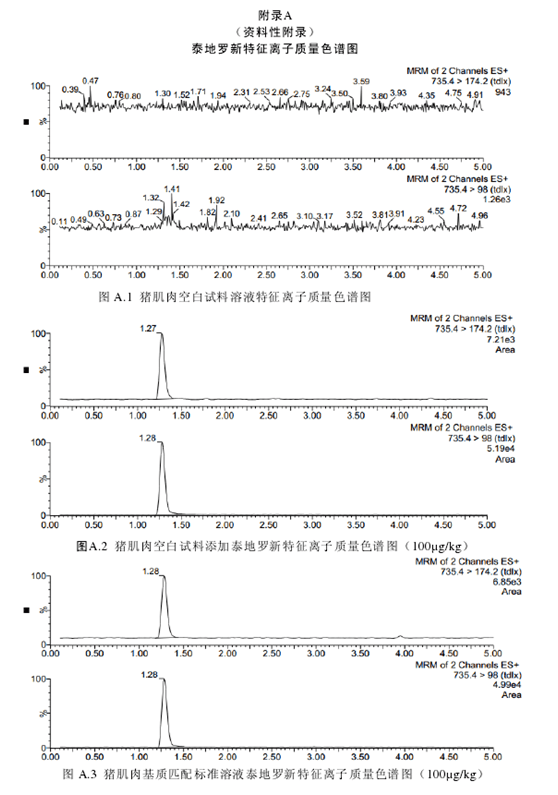
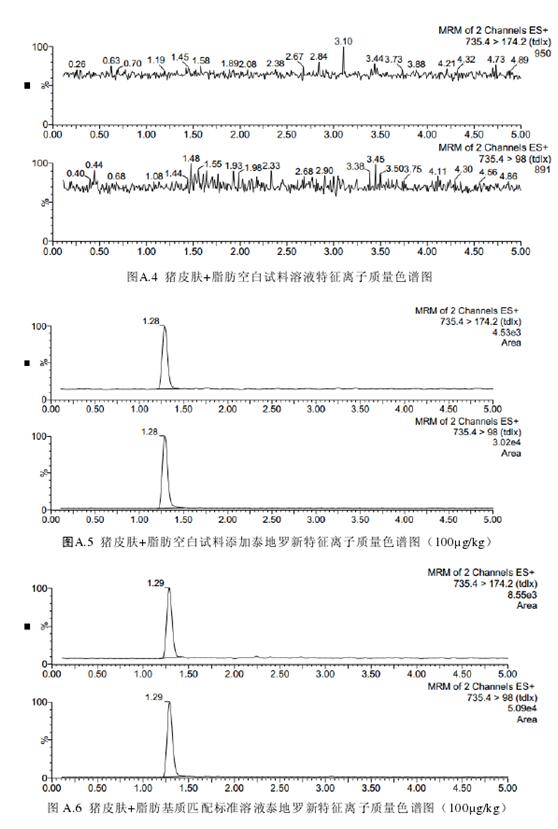
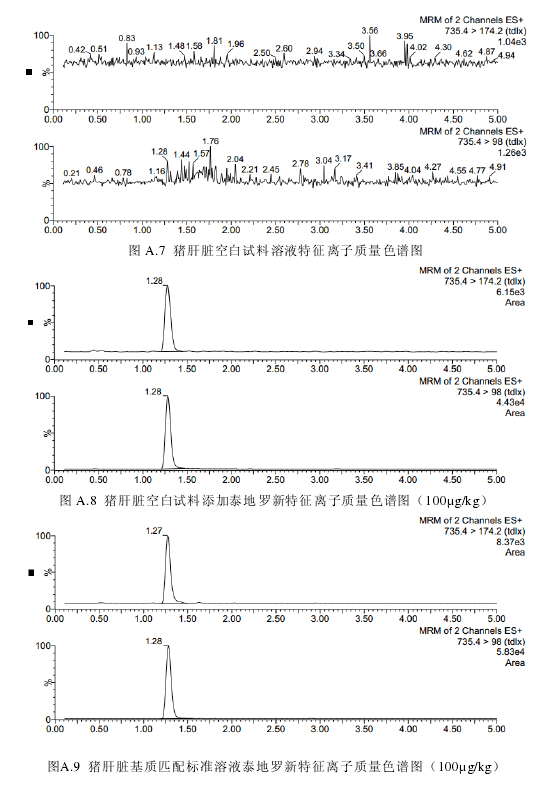
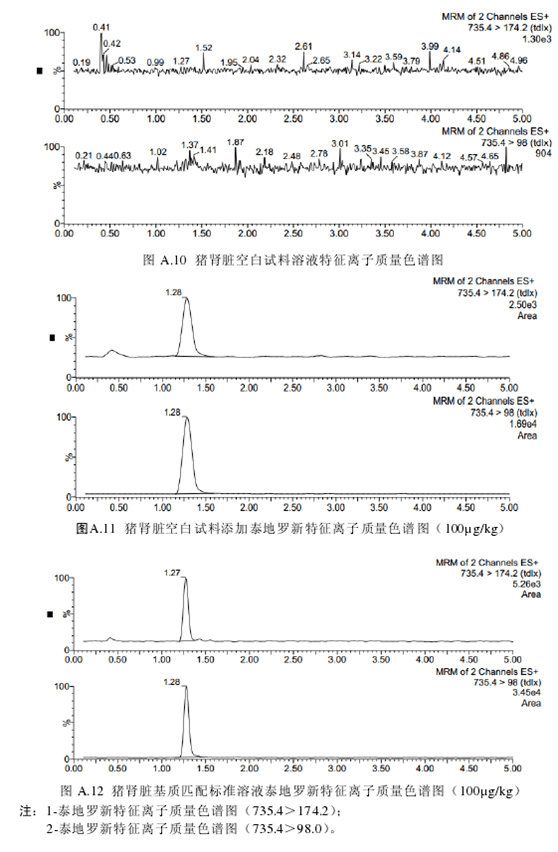
取试料溶液和基质匹配标准溶液,作单点或多点校准。按外标法,以峰面积计算。试料溶液和基质匹配标准溶液中泰地罗新的峰面积应在仪器检测的线性范围之内。试料溶液的保留时间在基质匹配标准溶液保留时间的±5%之内。试料溶液中的离子相对丰度与基质匹配标准溶液中的离子相对丰度相比,符合表3的要求。空白试料溶液、基质匹配标准溶液和空白试料添加溶液中各特征离子质量色谱图见附录A。
表3 试料溶液中离子相对丰度的允许偏差范围
|
相对丰度(%) |
允许偏差(%) |
|
>50 |
±20 |
|
>20~50 |
±25 |
|
>10~20 |
±30 |
|
≤10 |
±50 |
7.5 空白试验
取空白试料,采用完全相同的测定步骤进行平行操作。
8 结果计算和表述
单点校准,试料中药物残留量按下式计算:X=Cs×A/As×V/m
或基质匹配标准曲线校准:由As=aCs+b,求得a和b,则C=(A-B)÷a
试料中药物残留量按下式计算:X=CV÷m
式中:
X——试料中泰地罗新的残留量(µg/kg);
Cs——基质匹配标准溶液中泰地罗新的浓度(ng/ml);
A——试料溶液中泰地罗新峰面积;
As——基质匹配标准溶液中泰地罗新的峰面积;
V——溶解最终残余物定容后溶液体积(ml);
m——试料的质量(g);
C——试料溶液中泰地罗新浓度(ng/ml)。
注:计算结果需扣除空白值,测定结果用平行测定的算术平均值表示,保留三位有效数字。
9 检测方法灵敏度、准确度和精密度
9.1 灵敏度
泰地罗新在猪肌肉、皮肤+脂肪、肝脏、肾脏中的检测限为50µg/kg,定量限为100µg/kg。
9.2 准确度
本方法中猪肌肉、皮肤+脂肪、肝脏、肾脏分别在100µg/kg~2400µg/kg、100µg/kg~1600µg/kg、100µg/kg~10000µg/kg、100µg/kg~20000µg/kg的添加浓度范围内,泰地罗新的回收率范围为70%~110%。
9.3 精密度
本方法的批内相对标准偏差≤20%,批间相对标准偏差≤20%。
相关新闻
- 中华人民共和国农业农村部公告 第165号 2019-05-20
- 中华人民共和国农业农村部公告 第130号 2019-02-20
- 中华人民共和国农业农村部公告 第122号 2019-02-20
- 中华人民共和国农业农村部公告 第124号 2019-02-20
- 中华人民共和国农业农村部公告 第129号 2019-02-20



 提示信息
提示信息