中华人民共和国农业农村部公告 第165号
根据《兽药管理条例》和《兽药注册办法》规定,经审查,批准辉瑞意大利阿斯科利制药厂等3家公司生产的马来酸奥拉替尼片等3种产品在我国注册,核发《进口兽药注册证书》,并发布产品质量标准、说明书和标签,自发布之日起执行。
批准英特威国际有限公司意大利生产厂等2家公司生产的阿莫西林可溶性粉等2种兽药产品在我国再注册,核发《进口兽药注册证书》,并发布修订后的产品质量标准、说明书和标签,以及泰拉霉素每日允许摄入量和最高残留限量标准(试行)、泰拉霉素残留检测方法标准(试行)和阿莫西林残留检测方法标准(试行),自发布之日起执行。此前发布的上述产品兽药质量标准、说明书和标签同时废止。
批准KVP Kiel有限责任公司生产的复方非班太尔片变更兽药处方中已有药用要求的辅料、兽药质量标准等内容的变更注册和再注册,并发布修订后的产品质量标准、说明书和标签,自发布之日起执行。此前发布的该产品兽药质量标准、说明书和标签同时废止。
批准梅里亚有限公司法国吐鲁兹生产厂生产的阿福拉纳咀嚼片安全性内容变更注册。
特此公告。
附件:1.进口兽药注册目录
2.马来酸奥拉替尼片等6种兽药产品质量标准
3.马来酸奥拉替尼片等6兽药产品说明书和标签
4.泰拉霉素每日允许摄入量和最高残留限量标准(试行)
5.泰拉霉素残留检测方法标准(试行)
6.阿莫西林残留检测方法标准(试行)
农业农村部
2019年4月23日
附件1
进口兽药注册目录
|
兽药名称 |
生产厂名称 |
国 别 |
进口兽药 注册证书号 |
有效期限 |
备注 |
|
马来酸奥拉替尼片 Oclacitinib Maleate Tablet (3.6mg) |
辉瑞意大利阿斯科利制药厂 Pfizer ItaliaS. R. L. |
意大利 |
(2019)外兽药证字25号 |
2019.4. — 2024. 4. |
注册 |
|
马来酸奥拉替尼片 Oclacitinib Maleate Tablet (5.4mg) |
(2019)外兽药证字26号 |
||||
|
马来酸奥拉替尼片 Oclacitinib Maleate Tablet(16mg ) |
(2019)外兽药证字27号 |
||||
|
氟雷拉纳咀嚼片 Fluralaner Chewable Tablets(112.5mg) |
英特威国际有限公司奥地利厂 Intervet GesmbH |
奥地利 |
(2019)外兽药证字28号 |
2019.4. — 2024.4. |
注册 |
|
氟雷拉纳咀嚼片 Fluralaner Chewable Tablets(250mg) |
(2019)外兽药证字29号 |
||||
|
氟雷拉纳咀嚼片 Fluralaner Chewable Tablets(500mg) |
(2019)外兽药证字30号 |
||||
|
氟雷拉纳咀嚼片 Fluralaner Chewable Tablets(1000mg) |
(2019)外兽药证字31号 |
||||
|
氟雷拉纳咀嚼片 Fluralaner Chewable Tablets(1400mg) |
(2019)外兽药证字32号 |
||||
|
替米沙坦内服溶液(猫用) Telmisartan Oral Solution(For Cats)(30ml:0.12g) |
德国勃林格殷格翰动物保健有限公司墨西哥生产厂 Boehringer Ingelheim Promeco, S.A. de C.V. |
墨西哥 |
(2019)外兽药证字33号 |
2019.4. — 2024. 4. |
注册 |
|
替米沙坦内服溶液(猫用) Telmisartan Oral Solution(For Cats)(100ml:0.4g) |
(2019)外兽药证字34号 |
||||
|
阿莫西林可溶性粉 Amoxicillin Soluble Powder |
英特威国际有限公司意大利生产厂 Intervet Productions s.r.l. |
意大利 |
(2019)外兽药证字35号 |
2019.4. — 2024. 4.
|
再注册 |
|
泰拉霉素注射液 Tulathromycin Injection(20ml:2g) |
法瑞瓦公司法国生产厂 Fareva Amboise |
法国 |
(2019)外兽药证字36号 |
2019.4 — 2024.4 |
再注册 |
|
泰拉霉素注射液 Tulathromycin Injection(50ml:5g) |
(2019)外兽药证字37号 |
||||
|
泰拉霉素注射液 Tulathromycin Injection(100ml:10g) |
(2019)外兽药证字38号 |
||||
|
泰拉霉素注射液 Tulathromycin Injection(250ml:25g) |
(2019)外兽药证字39号 |
||||
|
泰拉霉素注射液 Tulathromycin Injection(500ml:50g) |
(2019)外兽药证字40号 |
||||
|
复方非班太尔片 Compound Febantel Tablets |
KVP Kiel有限责任公司 KVP Pharma+ Veterinär Produkte GmbH |
德国 |
(2019)外兽药证字41号 |
2019.4. — 2024.4. |
再注册 变更注册:兽药处方中已有药用要求的辅料、兽药质量标准、兽药有效期、兽药商品名称、注意事项等 |
|
阿福拉纳咀嚼片 Afoxolaner Chewable Tablets |
梅里亚有限公司法国吐鲁兹生产厂 MERIAL Toulouse |
法国 |
(2017)外兽药证字34号 |
2017.6.22 — 2022.6.21 |
变更注册:完善兽药说明书的安全性内容。 【不良反应】 由“按规定的用法与用量使用,暂未见不良反应;柯利牧羊犬以5倍计量内服(25mg/kg体重)时可引起腹泻和呕吐。”变更为“存在以下十分罕见的不良反应:轻度胃肠道反应(呕吐、腹泻)、瘙痒、嗜睡、食欲下降和神经症状(抽搐、共济失调和肌肉震颤)。多数不良反应具有自限性,且持续时间短(‘十分罕见’含义:包含个例药品的不良反应病例,发生率<0.1‰)。” |
附件2 略
附件3
马来酸奥拉替尼片等6种兽药产品说明书和标签
一、 马来酸奥拉替尼片说明书和标签
(一)马来酸奥拉替尼片说明书
兽用
【兽药名称】
通用名称:马来酸奥拉替尼片
商品名称:爱波克®(Apoquel®)
英文名称:Oclacitinib Maleate Tablet
汉语拼音:Malaisuan Aolatini Pian
【主要成分】 马来酸奥拉替尼
【性状】 本品为白色至类白色囊状包衣片,两侧均刻有AQ和半片刻痕以及对应不同片剂规格的S、M或L。
【药理作用】 奥拉替尼是一种合成的细胞内非受体酪氨酸激酶(Janus kinase,简称JAK)抑制剂,通过抑制多种依赖于JAK1、JAK3酶活性的诱发瘙痒、炎症的细胞因子以及与过敏有关的细胞因子起作用。该药对与造血有关的细胞因子(依赖于JAK2)没有影响。
犬经口服给药后,药物吸收迅速、良好。犬的进餐状态对吸收率或吸收程度无显著影响。静脉注射和口服给药的消除半衰期相似,药物绝对生物利用度为89%,与血浆蛋白结合率低(66.3%~69.7%)。药物在犬体内代谢为多种代谢物,在血浆和尿液中可检测到一种主要氧化代谢物。主要经代谢清除,也有部分通过肾脏和胆汁排泄。
该药物不属于皮质类固醇或抗组胺药。没有评价过本品与糖皮质激素、环孢菌素或其他全身用免疫抑制剂的联合用药。
【适应证】 用于控制犬过敏性皮炎引起的瘙痒症和异位性皮炎。
【用法与用量】 以奥拉替尼计。口服:每1kg体重,犬0.4~0.6mg,每日2次,连用14日。随后一日1次维持治疗。
推荐给药剂量表:
|
体重范围(kg) |
剂量(片) |
||
|
3.6mg/片 |
5.4mg/片 |
16mg/片 |
|
|
3.0~4.4 |
0.5 |
- |
- |
|
4.5~5.9 |
- |
0.5 |
- |
|
6.0~8.9 |
1 |
- |
- |
|
9.0~13.4 |
- |
1 |
- |
|
13.5~19.9 |
- |
- |
0.5 |
|
20.0~26.9 |
- |
2 |
- |
|
27.0~39.9 |
- |
- |
1 |
|
40.0~54.9 |
- |
- |
1.5 |
|
55.0~80.0 |
- |
- |
2 |
【不良反应】 可能增加感染的敏感性,包括蠕形螨病以及肿瘤恶化。
【注意事项】
1. 仅用于12月龄或以上犬。禁止用于12月龄以下或体重低于3kg的犬。禁止用于育种用犬、怀孕或哺乳母犬。禁止用于感染严重的犬。
2. 可以伴食给药或空腹给药。
3. 对使用本品的犬应监测感染的发展,包括蠕形螨病和肿瘤。
4. 人员在处理药片后,立即洗手。如眼睛接触到药物,立即用水或生理盐水冲洗至少15分钟,随后就医。
5. 避免儿童接触本品。
6. 一旦有人员意外吞食,必须立刻就医并告知医生相关情况。
【休药期】 不需要制定。
【规格】 以C15H23N5O2S计(1)3.6mg (2)5.4mg (1)16mg
【包装】
【贮藏】 20~25℃保存,可在15~40℃条件下运输。
【有效期】 24个月。
【进口兽药注册证号】
【生产企业】 辉瑞意大利阿斯科利制药厂(Pfizer Italia S. R. L.)
地址:Via del Commercio 25/27, Marino Del Tronto, Ascoli Piceno (AP), 63100, Italy
(二)马来酸奥拉替尼片标签
兽用
【兽药名称】
通用名称:马来酸奥拉替尼片
商品名称:爱波克®(Apoquel®)
英文名称:Oclacitinib Maleate Tablet
汉语拼音:Malaisuan Aolatini Pian
【主要成分】 马来酸奥拉替尼
【性状】 本品为白色至类白色囊状包衣片,两侧均刻有AQ和半片刻痕以及对应不同片剂规格的S、M或L。
【适应证】 用于控制犬过敏性皮炎引起的瘙痒症和异位性皮炎。
【用法与用量】 以奥拉替尼计。口服:每1kg体重,犬0.4~0.6mg,每日2次,连用14日。随后一日1次维持治疗。
【规格】 以C15H23N5O2S计(1)3.6mg (2)5.4mg (3)16mg
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【休药期】 不需要制定。
【包装】
【贮藏】 20~25℃保存,可在15~40℃条件下运输。
【生产企业】 辉瑞意大利阿斯科利制药厂(Pfizer Italia S. R. L.)
地址:Via del Commercio 25/27, Marino Del Tronto, Ascoli Piceno (AP), 63100, Italy
二、氟雷拉纳咀嚼片说明书和标签
(一)氟雷拉纳咀嚼片说明书
宠物用
【兽药名称】
通用名称:氟雷拉纳咀嚼片
商品名称:贝卫多(BRAVECTO®)
英文名称:Fluralaner Chewable Tablets
汉语拼音:Fuleilana Jujuepian
【主要成分】 氟雷拉纳
【性状】 本品为浅棕色至深棕色圆形片。
【药理作用】 药效学 氟雷拉纳是一种异噁唑啉类的杀虫剂和杀螨剂,通过拮抗γ-氨基丁酸受体和谷氨酸受体门控氯离子通道,使氯离子无法渗透进入突触后膜,干扰神经系统的跨膜信号传递,导致昆虫神经系统紊乱,进而死亡。氟雷拉纳与狄氏剂不具有交叉耐药性。
氟雷拉纳为全身性抗寄生虫药,驱杀犬体表的跳蚤和蜱的作用可持续12周。氟雷拉纳对猫栉首蚤和犬栉首蚤有驱杀作用,对成年跳蚤起效快,持续时间长,还可阻止跳蚤产卵,因此破坏了跳蚤的生命周期。氟雷拉纳对蓖子硬蜱(幼蜱、若蜱和成蜱)、六角硬蜱、肩突硬蜱、全环硬蜱、网纹革蜱、变异革蜱及血红扇头蜱也有杀灭作用。
药动学 氟雷拉纳内服容易吸收,1日内可达最大血药浓度,食物可促进其吸收。氟雷拉纳呈全身性分布,脂肪中浓度最高,其次为肝脏、肾脏和肌肉。氟雷拉纳在犬体内几乎不被代谢,血浆消除半衰期约为12日,使氟雷拉纳在给药期间可维持有效血药浓度,最大血药浓度和血浆消除半衰期存在个体差异。氟雷拉纳约90%以原形经粪便排泄,少量经肾排泄。
【适应证】 用于治疗犬体表的跳蚤和蜱感染,还可辅助治疗因跳蚤引起的过敏性皮炎。
【用法与用量】 以本品计。内服:犬按下表中的体重范围给药,每12周给药1次。
|
体重(kg) |
规格 |
数量 |
|
≥2~≤4.5 |
112.5mg/片 |
1 |
|
>4.5~≤10 |
250mg/片 |
1 |
|
>10~≤20 |
500mg/片 |
1 |
|
>20~≤40 |
1000mg/片 |
1 |
|
>40~≤56 |
1400mg/片 |
1 |
|
>56 |
选择合适的规格组合使用 |
|
【不良反应】
1. 极个别犬(1.6%)会出现轻微短暂的胃肠道反应,如腹泻、呕吐、食欲不振、流涎。
2. 8~9周龄体重为2.0~3.6kg的幼犬,内服5倍最大推荐剂量的氟雷拉纳,每8周给药1次,共给药3次,未观察到不良反应。
3. 比格犬内服3倍最大推荐剂量的氟雷拉纳,未发现对繁殖能力有影响,也未发现对后代生存能力有影响。
4. 柯利牧羊犬的多药耐药基因缺失(MDR1-/-),内服3倍最大推荐剂量的氟雷拉纳,具有良好耐受性,未观察到治疗相关的临床症状。
【注意事项】
1. 本品不得用于8周以下的幼犬和/或体重低于2kg的犬。
2. 对本品过敏的犬勿用。
3. 本品的给药间隔不得低于8周。
4. 可用于种犬、妊娠期和泌乳期的母犬。
5. 氟雷拉纳与血浆蛋白结合率高,可能与其他高蛋白结合率的药物竞争血浆蛋白结合,如非甾体抗炎药、香豆素衍生物华法林等。体外血浆孵育试验,未发现氟雷拉纳与卡洛芬和华法林竞争血浆蛋白结合。临床试验未发现氟雷拉纳与犬的日常用药存在相互作用。
6. 若出现任何严重反应或本说明书未提及的其他不良反应,请及时就医。
7. 本品起效快,可降低虫媒病的传播风险,但跳蚤和蜱必须接触宿主并且开始进食才能接触活性药物成分,跳蚤(猫栉首蚤)在接触后8小时内起作用,蜱(蓖子硬蜱)接触后12小时内起作用,因此,在极其恶劣条件下,不能完全排除通过寄生虫为媒介进行疾病传播的风险。
8. 除直接饲喂以外,可将本品混入犬粮中饲喂,给药时观察犬只,确认犬只吞下药物。
9. 给药时,给药人员不得进食、喝酒或吸烟;接触本品后,应立即用肥皂和水彻底清洗双手。
10. 避免儿童接触。
11. 使用前请检查包装是否完好,如有破损请勿使用。
12. 未使用完的兽药及包材,应按照当地法规要求进行处理。
【休药期】 无需制定。
【规格】 (1)112.5mg (2)250mg (3)500mg (4)1000mg (5)1400mg
【包装】
【贮藏】 30℃以下密封保存。
【有效期】 24个月。
【进口兽药注册证号】
【生产企业】 英特威国际有限公司奥地利生产厂(Intervet GesmbH)
地址:Siemensstrasse 107, 1210 Vienna, Austria
(二)氟雷拉纳咀嚼片标签
宠物用
【兽药名称】
通用名称:氟雷拉纳咀嚼片
商品名称:贝卫多(BRAVECTO®)
英文名称:Fluralaner Chewable Tablets
汉语拼音:Fuleilana Jujuepian
【主要成分】 氟雷拉纳
【性状】 本品为浅棕色至深棕色圆形片。
【适应证】 用于治疗犬体表的跳蚤和蜱感染,还可辅助治疗因跳蚤引起的过敏性皮炎。
【用法与用量】 以本品计。内服:犬按体重范围给药,每12周给药1次(具体见说明书)。
【规格】 (1)112.5mg (2)250mg (3)500mg (4)1000mg (5)1400mg
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【休药期】 无需制定。
【贮藏】 30℃以下密封保存。
【包装】
【生产企业】 英特威国际有限公司奥地利生产厂(Intervet GesmbH)
地址:Siemensstrasse 107, 1210 Vienna, Austria
三、替米沙坦内服溶液(猫用)说明书和标签
(一)替米沙坦内服溶液(猫用)说明书
宠物用
【兽药名称】
通用名称:替米沙坦内服溶液(猫用)
商品名称:圣咪乐®
英文名称:Telmisartan oral solution(For Cats)
汉语拼音:Timishatan Neifurongye(Maoyong)
【主要成分】 替米沙坦
【性状】 本品为无色至微黄色的黏稠澄清液体。
【药理作用】药效学 替米沙坦为特异性血管紧张素II受体1型(AT1)拮抗剂。AT1受体激活与血管紧张素II对肾脏的血管收缩、水钠潴留、醛固酮合成增加和器官重塑效应有关,AT2受体激活与血管舒张、尿钠排泄和抑制非正常细胞增殖有关。替米沙坦对AT1具有高度选择性,对其他AT亚型无亲和力。替米沙坦对AT1亲和力强,解离缓慢,为AT1完全拮抗剂,无部分激动剂作用。替米沙坦通过与AT1结合,可使猫的平均动脉血压呈剂量依赖性下降。临床试验显示,患有慢性肾病的猫内服替米沙坦7日内,蛋白尿减少。大鼠离体肾脏灌注实验显示,替米沙坦可使肾脏灌流液流速、尿流速和肾小球滤过率呈剂量依赖性增加。大鼠和犬的肾脏效应试验显示,替米沙坦可使尿量和钠排泄显著增加,对肾功能具有有利作用。
药动学 本品内服吸收迅速,食物不影响吸收。猫按每1kg体重1mg内服替米沙坦,30分钟后血药浓度达峰值,绝对生物利用度为33%。在0.5mg~3mg/kg体重剂量范围,血药峰浓度(Cmax)和药时曲线下面积(AUC)均呈剂量依赖性增加。替米沙坦与血浆蛋白结合率大于99.5%,主要与白蛋白和α-1酸性糖蛋白结合。替米沙坦亲脂性较高,容易分布到组织中,每日一次连续21日给药,未见蓄积效应。替米沙坦在猫体内被葡糖苷酸化,生成1-O-酰基葡糖苷酸代谢产物。终末消除半衰期平均为7.7小时(7.3~8.6小时),几乎全部以原形经粪便排泄。无性别差异。
【适应证】 用于治疗猫慢性肾病引起的蛋白尿。
【用法与用量】 以替米沙坦计。内服:一次量,每1kg体重,猫1mg(0.25 ml),一日1次。
直接注入口腔或与少量饲料一起给药。推荐使用包装中提供的带刻度注射器给药,向下按压瓶盖并旋转打开,以活塞末端刻度为准,用注射器准确抽取与猫体重对应的药量。取下注射器,直接将药物推入猫口腔内或与少量食物同食。使用后,拧紧瓶盖,用水清洗注射器并保持干燥。
【不良反应】
1. 本品可能出现轻微而短暂的胃肠道症状,发生率按降序排列,依次为:轻微的间歇性食管反流、呕吐、腹泻和软便,但这些症状在临床试验中极少观察到。
2. 偶见肝脏酶升高,停药后几日内可恢复正常。
3. 按推荐剂量治疗时,可发生与药效相关的低血压和红细胞计数下降。
4. 过量给予本品(最高达推荐剂量的5倍,连续给药6个月)可导致血压明显下降、红细胞计数下降和血尿素氮升高,但在临床治疗应用中不太可能出现所述反应。
【禁忌症】
1. 尚未确定本品在交配、妊娠或哺乳期猫中的安全性。禁用于妊娠或哺乳期的猫。
2. 禁用于已知对替米沙坦过敏的猫。
【注意事项】
1. 本品的用药时程由兽医根据疾病严重程度及转归决定给药次数。
2. 尚未对小于6月龄的猫进行安全性和有效性试验评价。
3. 对于麻醉后接受本品治疗的猫,需监测其血压。
4. 由于本品的作用机制,可能会发生一过性低血压,在出现任何具有临床意义的低血压体征时,应给予对症治疗,如输液。
5. 与已知作用于肾素-血管紧张素-醛固酮系统(RAAS)的物质一样,可能会发生红细胞计数轻度下降,治疗期间应监测红细胞计数。
6. 与推荐剂量氨氯地平联合治疗时,临床未见低血压。
7. 尚未开展联合用药研究,本品不得与其他兽药混合使用。
8. 请置于儿童不易触及处。
9. 如果发生意外吞食,应立即就医,并向医生出示本品的说明书或标签。
10. 避免接触眼睛,如果意外接触眼睛,立即用清水冲洗,给药后请清洗双手。
11. 已知作用于RAAS的物质(如血管紧张素受体拮抗剂[ARB]和血管紧张素I转化酶抑制剂 [ACEI])可影响妊娠期胎儿,因此孕妇应避免接触本品。
12. 已知对替米沙坦或其他血管紧张素II受体拮抗剂过敏者应避免接触本品。
13. 药品不得通过废水或按家庭垃圾处置,请咨询兽医或按当地规定处置本品。
【休药期】 无需制定。
【规格】 以C33H30N4O2计 (1)30ml:0.12g (2)100ml:0.4g
【包装】
【贮藏】 密封保存。
【有效期】 36个月,开启后6个月。
【进口兽药注册证号】
【生产企业】 德国勃林格殷格翰动物保健有限公司墨西哥生产厂(Boehringer Ingelheim Promeco, S.A. de C.V.)
地址:Calle Maíz No. 49, Barrio Xaltocan, Código Postal 16090, Ciudad de México
(二)替米沙坦内服溶液(猫用)标签
替米沙坦内服溶液(猫用)内标签
宠物用
【兽药名称】
通用名称:替米沙坦内服溶液(猫用)
商品名称:圣咪乐®
英文名称:Telmisartan oral solution(For Cats)
汉语拼音:Timishatan Neifurongye(Maoyong)
【主要成分】 替米沙坦
【适应证】 详见说明书。
【用法与用量】 详见说明书
【规格】 以C33H30N4O2计 (1)30ml:0.12g (2)100ml:0.4g
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【贮藏】 密封保存。
【生产企业】 德国勃林格殷格翰动物保健有限公司墨西哥生产厂(Boehringer Ingelheim Promeco, S.A. de C.V.
地址:Calle Maíz No. 49, Barrio Xaltocan, Código Postal 16090, Ciudad de México
替米沙坦内服溶液(猫用)外标签
宠物用
【兽药名称】
通用名称:替米沙坦内服溶液(猫用)
商品名称:圣咪乐®
英文名称:Telmisartan oral solution(For Cats)
汉语拼音:Timishatan Neifurongye(Maoyong)
【主要成分】 替米沙坦
【性状】 本品为无色至微黄色的黏稠澄清液体。
【适应证】 用于治疗猫慢性肾病引起的蛋白尿。
【用法与用量】 以替米沙坦计。内服:一次量,每1kg体重,猫1mg(0.25 ml),一日1次。直接注入口腔或与少量饲料一起给药。推荐使用包装中提供的带刻度注射器给药,详见说明书。
【进口兽药注册证号】
【规格】 以C33H30N4O2计 (1)30ml:0.12g (2)100ml:0.4g
【包装】
【生产日期】
【生产批号】
【有效期】至
【休药期】 无需制定。
【贮藏】 密封保存。
【生产企业】 德国勃林格殷格翰动物保健有限公司墨西哥生产厂(Boehringer Ingelheim Promeco, S.A. de C.V.)
地址:Calle Maíz No. 49, Barrio Xaltocan, Código Postal 16090, Ciudad de México
四、阿莫西林可溶性粉说明书和标签
(一)阿莫西林可溶性粉说明书
兽用处方药
【兽药名称】
通用名称:阿莫西林可溶性粉
商品名称:派乐新
英文名称:Amoxicillin Soluble Powder
汉语拼音:Amoxilin Kerongxingfen
【主要成分】 阿莫西林三水合物
【性状】 本品为白色至淡黄色粉末。
【药理作用】 β-内酰胺类抗生素。阿莫西林具有广谱抗菌作用,通过抑制细菌细胞壁的合成发挥其抑菌作用,对感染家禽的革兰氏阴性菌有抑菌作用,如葡萄球菌、链球菌、巴氏杆菌、梭状芽孢杆菌、沙门氏菌、副禽嗜血杆菌、大肠埃希菌及鼻气管鸟杆菌等有较强作用,但这些细菌易产生耐药性。适用于敏感菌所致的呼吸系统、泌尿系统、皮肤及软组织等全身性感染。
【适应证】 主要用于治疗鸡对阿莫西林敏感的革兰氏阳性菌和阴性菌感染。
【用法与用量】 以本品计。混饮,每1kg体重,鸡,10~20mg,一日1次,连用3~5日;或每100L水,0~4周龄,6~12g,4周龄以上,10~20g。
【不良反应】 按推荐剂量使用,未见不良反应。
【注意事项】
1.本品禁止口服或肠道外给药用于小型草食动物,如豚鼠、仓鼠和兔。
2.对青霉素类或头孢菌素类过敏的个体应避免接触本品。
3.处理过程中,应谨慎,避免吸入粉尘或接触皮肤。
【休药期】 鸡7日,蛋鸡产蛋期禁用。
【规格】 80%
【包装】
【贮藏】 遮光,密封,25℃以下保存。
【有效期】 36个月。
【进口兽药注册证号】
【生产企业】 英特威国际有限公司意大利生产厂(Intervet Productions s.r.l.)
地址:Via Nettunense KM. 20, 300 Aprilia (LT),Italy
(二)阿莫西林可溶性粉标签
兽用处方药
【兽药名称】
通用名称:阿莫西林可溶性粉
商品名称:派乐新
英文名称:Amoxicillin Soluble Powder
汉语拼音:Amoxilin Kerongxingfen
【主要成分】 阿莫西林三水合物
【性状】 本品为白色至淡黄色粉末。
【适应证】 主要用于治疗鸡对阿莫西林敏感的革兰氏阳性菌和阴性菌感染。
【用法与用量】 以本品计。混饮,每1kg体重,鸡10~20mg,一日一次,连用3~5日;或每100L水,0~4周龄鸡,6~12g,4周龄以上鸡,10~20g。
【规格】 80%
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】 至
【休药期】 鸡7日,蛋鸡产蛋期禁用。
【贮藏】 遮光,密封,25℃以下保存。
【包装】
【生产企业】 英特威国际有限公司意大利生产厂(Intervet Productions s.r.l.)
地址:Via Nettunense KM. 20, 300 Aprilia (LT),Italy
五、泰拉霉素注射液说明书和标签
(一)泰拉霉素注射液说明书
兽用
【兽药名称】
通用名称:泰拉霉素注射液
商品名称:瑞可新®(Draxxin®)
英文名称:Tulathromycin Injection
汉语拼音:Tailameisu Zhusheye
【主要成分】 泰拉霉素
【性状】 本品为无色至微黄色澄明液体。
【药理作用】 大环内酯类抗生素。泰拉霉素是一个半合成的大环内酯类抗生素。大环内酯抗生素通过与细菌核糖体RNA选择性地结合来抑制必需蛋白质的生物合成。它们通过在易位过程中促进多肽-tRNA从核糖体解离而起作用。与其他许多大环内酯类抗生素不同的是,它的药物作用保持时间较长,部分原因是由于其结构中有3个氨基基团。泰拉霉素在体外可有效抑制牛溶血巴氏杆菌、多杀性巴氏杆菌、睡眠嗜血杆菌和牛支原体以及猪胸膜肺炎放线杆菌、多杀性巴氏杆菌和肺炎支原体。
牛一次皮下注射(2.5mg/kg体重)的药动学研究表明,该药可快速而广泛的吸收,然后大量分布和缓慢消除。血浆中的最大浓度(Cmax)约为0.5μg/ml,给药后约30分钟(Tmax)达最大浓度。在肺匀浆中的浓度比血浆高。有充分的证据说明,泰拉霉素在嗜中性粒细胞和肺泡巨噬细胞中有大量蓄积。药物达峰后,缓慢衰减,血浆中的表观消除半衰期(t1/2)为90小时。血浆蛋白结合率较低,约为40%。牛皮下注射的生物利用度约为90%。
猪一次肌内注射(2.5mg/kg体重)的药动学研究表明,该药可快速而广泛的吸收,然后大量分布和缓慢消除。血浆中的最大浓度(Cmax)约为0.6μg/ml,给药后约30分钟(Tmax)达最大浓度。在肺匀浆中的浓度比血浆高。有充分的证据说明,泰拉霉素在嗜中性粒细胞和肺泡巨噬细胞中有大量蓄积。药物达峰后,缓慢衰减,血浆中的表观消除半衰期(t1/2)为91小时。血浆蛋白结合率较低,约为40%。猪肌内注射的生物利用度约为88%。
【适应证】 治疗和预防对泰拉霉素敏感的溶血巴氏杆菌、多杀巴氏杆菌、睡眠嗜血杆菌和支原体引起的牛呼吸道疾病;治疗和预防对泰拉霉素敏感的胸膜肺炎放线杆菌、多杀巴氏杆菌和肺炎支原体引起的猪呼吸道疾病。
【用法与用量】 以泰拉霉素计。皮下注射:一次量,每1kg体重,牛2.5mg(相当于1ml/40kg体重)。每个注射部位的给药剂量不超过7.5ml。
颈部肌内注射:一次量,每1kg体重,猪2.5mg(相当于1ml/40kg体重)。每个注射部位的给药剂量不超过2ml。
【不良反应】 牛皮下注射本品时,常会引起注射部位出现短暂性的疼痛反应和局部肿胀,并可持续长达30日。猪肌肉注射后未见上述反应。在注射后约30日内,两种动物的注射部位仍有组织病理变化。
【注意事项】
1. 对大环内酯类抗生素过敏的动物禁用。
2. 本品不能与其它大环内酯类抗生素或林可霉素同时使用。
3. 供生产人用乳品的泌乳期奶牛禁用。
4. 预计在2个月内分娩的可能生产人用乳品的怀孕母牛禁用。
5. 当多次取药时,建议使用专用吸取针头或多剂量注射器,以避免在瓶塞上扎孔过多。
6. 建议在疾病的早期进行治疗,在给药后48小时内评价治疗效果。如果呼吸道疾病的症状仍然存在或增加,或出现复发,应改变治疗方案。
7. 泰拉霉素对眼睛有刺激性,如果眼睛意外接触到本品,请立即用清水冲洗。
8. 皮肤接触到泰拉霉素时,可引起过敏反应。如果皮肤意外接触到本品,请立即用肥皂和水冲洗。
9. 用后请洗手。
10. 置于儿童不可触及处。
【休药期】 牛49日;猪33日。
【规格】 (1)20ml:2g (2)50ml:5g (3)100ml:10g (4)250ml:25g (5)500ml:50g
【包装】
【贮藏】 避光,密闭,在凉暗处保存。
【有效期】 36个月。开启后,28日。
【进口兽药注册证号】
【生产企业】法瑞瓦公司法国生产厂(Fareva Amboise)
地址:Zone Industrielle,29 Route Des Industries,37530 Poce Sur Cisse,France
(二)泰拉霉素注射液标签
兽用
【兽药名称】
通用名称:泰拉霉素注射液
商品名称:瑞可新®(Draxxin®)
英文名称:Tulathromycin Injection
汉语拼音:Tailameisu Zhusheye
【主要成分】 泰拉霉素
【性状】 本品为无色至微黄色澄明液体。
【适应证】 治疗和预防对泰拉霉素敏感的溶血巴氏杆菌、多杀巴氏杆菌、睡眠嗜血杆菌和支原体引起的牛呼吸道疾病;治疗和预防对泰拉霉素敏感的胸膜肺炎放线杆菌、多杀巴氏杆菌和肺炎支原体引起的猪呼吸道疾病。
【用法与用量】 以泰拉霉素计。皮下注射:一次量,每1kg体重,牛2.5mg(相当于1ml/40kg体重)。每个注射部位的给药剂量不超过7.5ml。
颈部肌内注射:一次量,每1kg体重,猪2.5mg(相当于1ml/40kg体重)。每个注射部位的给药剂量不超过2ml。
【规格】 (1)20ml:2g (2)50ml:5g (3)100ml:10g (4)250ml:25g (5)500ml:50g
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【休药期】 牛49日;猪33日。
【包装】
【贮藏】 避光,密闭,在凉暗处保存。
【生产企业】 法瑞瓦公司法国生产厂(Fareva Amboise)
地址:Zone Industrielle, 29 Route Des Industries, 37530 Poce Sur Cisse, France
六、复方非班太尔片说明书和标签
(一)复方非班太尔片说明书
兽用
【兽药名称】
通用名称:复方非班太尔片
商品名称:拜宠清(Drontal® Plus Tasty)
英文名称:Compound Febantel Tablets
汉语拼音:Fufang Feibantai’er Pian
【主要成分】 非班太尔、吡喹酮、双羟萘酸噻嘧啶
【性状】 本品为浅褐色至褐色片。
【药理作用】 抗蠕虫药。吡喹酮为广谱抗吸虫和绦虫药,与虫体接触后,能被虫体迅速吸收,首先使虫体痉挛,然后使合胞体外皮迅速形成空泡,并逐渐扩大,最后表皮糜烂至溶解。虫体皮层破坏后,不仅影响虫体吸收和排泄功能,而且导致虫体体表抗原暴露,从而容易遭受宿主免疫攻击,促使虫体死亡。同时还有继发性作用,使虫体表膜去极化,皮层碱性磷酸酶活性降低,以致葡萄糖摄入受阻,内源性糖原耗竭。而且还可抑制虫体的核酸与蛋白质合成。双羟萘酸噻嘧啶为广谱驱线虫药,通过抑制虫体胆碱酯酶,使虫体肌肉强烈收缩,并导致痉挛性麻痹。非班太尔为苯并咪唑类前体广谱驱线虫药,在动物的胃肠道内转变成芬苯达唑(及其亚砜)和奥芬达唑而发挥有效的驱虫效应。本品中非班太尔和双羟萘酸噻嘧啶组方具有协同作用,使本品的抗线虫谱更广,吡喹酮与非班太尔和双羟萘酸噻嘧啶组方具有相加作用,将本品驱虫谱再扩宽至绦虫。
【适应证】 用于治疗宠物犬的线虫和绦虫感染,如犬弓首蛔虫、犬狮蛔虫、犬窄头钩虫、犬钩口线虫、毛首线虫、棘球绦虫、带绦虫、复孔绦虫等。
【用法与用量】 以本品计。内服:一次量,每10kg体重,犬1片(相当于1kg体重,非班太尔15mg、吡喹酮5mg、双羟萘酸噻嘧啶14.4mg)。每增加5kg体重,增食半片本品,详见下表:
|
犬体重(kg) |
使用剂量(片) |
|
2-5 |
½ |
|
>5-10 |
1 |
|
>10-15 |
1 ½ |
|
>15-20 |
2 |
可直接吞服或包于肉或食物中给药,无需禁食。
用于控制犬弓首蛔虫时,哺乳的母犬应在产后2周投药,且每2周给药1次至断奶。幼犬也应在2周龄时给药,且每2周给药1次至12周龄,随后每3个月给药1次。建议在给母犬投药的同时也给幼犬投药。
对于线虫感染严重的犬,应在首次投药2周后再重复给药1次。
成年狗例行驱虫,每3个月1次。
【不良反应】 按推荐剂量使用,未见不良反应。超剂量使用时,犬偶见呕吐。
【注意事项】
1. 本品仅用于2kg以上的宠物犬。
2. 妊娠母犬可用,须严格按照推荐剂量使用。
3. 勿与哌嗪类药物同时使用。
4. 勿让儿童接触本品。
5. 工作人员投药后应洗手。药片使用后的剩余部分勿留用。
【休药期】 不需要制定。
【规格】
【包装】
【贮藏】 密封保存。
【有效期】 36个月。
【进口兽药注册证号】
【生产企业】 KVP Kiel有限责任公司(KVP Pharma+Veterinär Produkte GmbH)
地址:Projensdorfer Straβe 324, 24106, Kiel, Germany
(二)复方非班太尔片标签
复方非班太尔片标签
兽用
【兽药名称】
通用名称:复方非班太尔片
商品名称:拜宠清(Drontal® Plus Tasty)
英文名称:Compound Febantel Tablets
汉语拼音:Fufang Feibantai’er Pian
【主要成分】 非班太尔、吡喹酮、双羟萘酸噻嘧啶
【性状】 本品为浅褐色至褐色片。
【适应证】 用于治疗宠物犬的线虫和绦虫感染,如犬弓首蛔虫、犬狮蛔虫、犬窄头钩虫、犬钩口线虫、毛首线虫、棘球绦虫、带绦虫、复孔绦虫等。
【用法与用量】 以本品计。内服:一次量,每10kg体重,犬1片(详见说明书)。
【规格】
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【休药期】 不需要制定。
【贮藏】 密封保存。
【包装】
【生产企业】 KVP Kiel有限责任公司(KVP Pharma+Veterinär Produkte GmbH)
地址:Projensdorfer Straβe 324, 24106, Kiel, Germany
附件4
泰拉霉素每日允许摄入量和最高残留限量标准(试行)
申报单位参照欧盟有关标准制定了泰拉霉素的每日允许摄入量(ADI)和泰拉霉素在猪、牛可食性组织中的最高残留限量(MRLs),如下表:
|
活性成分 |
残留标志物 |
动物品种 |
靶组织 |
MRLs |
|
泰拉霉素 ADI:0~50µg/kg b.w./d |
(2R,3S,4R,5R,8R,10R,11R,12S,13S,14R)-2-乙基-3,4,10,13-四羟基-3,5,8,10,12,14-六甲基-11-[[3,4,6-三脱氧-3-(二甲胺基)-β-D-木-吡喃型己糖基]氧]-1-氧杂-6-氮杂环十五烷-15-酮 |
猪 |
肌肉 脂肪(皮+脂) 肝脏 肾脏 |
300µg•kg-1 800µg•kg-1 4000µg•kg-1 8000µg•kg-1 |
|
牛 |
肌肉 脂肪 肝脏 肾脏 |
300µg•kg-1 200µg•kg-1 4500µg•kg-1 3000µg•kg-1 |
附件5
泰拉霉素残留检测方法标准(试行)
猪、牛可食性组织中泰拉霉素残留量的测定 液相色谱-串联质谱法(试行)
1 范围
本标准规定了猪、牛可食性组织中泰拉霉素残留量的测定方法——液相色谱-串联质谱法。
本标准适用于猪和牛的肌肉、肝脏、肾脏、脂肪(皮+脂)中泰拉霉素残留量的检测。
2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本文件。
GB/T 1.1-2009 标准化工作导则 第1部分:标准的结构和编写规则
GB/T 6682 分析实验室用水规格和试验方法
3 原理
试料中残留的泰拉霉素用盐酸溶液水浴消化提取,固相萃取柱净化,液相色谱-串联质谱法测定,内标法定量。
4 试剂和材料
以下所用的试剂,除特别注明者外均为分析纯试剂;水为符合GB/T 6682规定的一级水。
4.1 泰拉霉素对照品:纯度≥99%。
4.2 泰拉霉素代谢物对照品:纯度≥99%。
4.3 内标阿奇霉素德糖胺对照品:纯度≥99%。
4.4 乙腈:色谱纯。
4.5 磷酸氢二钾。
4.6 柠檬酸。
4.7 盐酸。
4.8 甲醇:色谱纯。
4.9 浓氨溶液:色谱纯。
4.10 磷酸。
4.11 柠檬酸钠。
4.12 氢氧化钠。
4.13 甲酸:色谱纯。
4.14 MCX固相萃取柱:60mg/3mL,或效能相当者。
4.15 0.05mol/L磷酸氢二钾溶液-乙腈溶液(75:25)(pH6.0):取磷酸氢二钾8.71g,加水1000mL溶解制成0.05mol/L磷酸氢二钾溶液。临用前取0.05mol/L磷酸氢二钾溶液300mL与乙腈100mL混合,用磷酸调节pH值至6.0,即得。2~8℃保存。
4.16 0.05mol/L柠檬酸缓冲液(pH5.5):甲液:取柠檬酸19.21 g,加水使溶解成1000 mL,2~8℃保存。乙液:取柠檬酸钠29.41g,加水使溶解成1000 mL,2~8℃保存。取上述甲液144mL与乙液356mL混合,再加水稀释至1000mL,用1mol/L氢氧化钠溶液调节pH值至5.5,即得。2~8℃保存。
4.17 1400μg/mL泰拉霉素标准贮备液:精密称取泰拉霉素对照品约14mg,于10mL容量瓶中,用0.05mol/L磷酸氢二钾溶液-乙腈溶液(75:25)(pH6.0)溶解并稀释至刻度,配成浓度为1400μg/mL的泰拉霉素标准贮备液。2~8℃保存,有效期3个月。
4.18 420 μg/mL泰拉霉素标准工作液:精密量取1400μg/mL泰拉霉素标准储贮备液3.0mL,于10mL容量瓶中,用0.05 mol/L磷酸氢二钾溶液-乙腈溶液(75:25)(pH6.0)稀释至刻度,配成浓度为420μg/mL的泰拉霉素标准工作液。2~8℃保存,有效期3个月。
4.19 100μg/mL泰拉霉素代谢物标准贮备液:精密称取泰拉霉素代谢物对照品约1mg,于10mL容量瓶中,用0.05mol/L柠檬酸缓冲液(pH5.5)溶解并稀释至刻度,配成浓度为100μg/mL的标准贮备液。2~8℃保存,有效期4个月。
4.20 30μg/mL泰拉霉素代谢物标准工作液:精密量取100μg/mL泰拉霉素代谢物标准贮备液3.0mL,于10mL容量瓶中,用0.05mol/L柠檬酸缓冲液(pH5.5)稀释至刻度,配成浓度为30μg/mL的泰拉霉素代谢物标准工作液。2~8℃保存,有效期4个月。
4.21 100μg/mL内标阿奇霉素德糖胺标准贮备液:精密称取内标阿奇霉素德糖胺对照品约1mg,于10mL容量瓶中,用0.05mol/L柠檬酸缓冲液(pH5.5)溶解并稀释至刻度,配成浓度为100μg/mL的内标阿奇霉素德糖胺标准贮备液。2~8℃保存,有效期1.5个月。
4.22 600μg/L内标阿奇霉素德糖胺标准工作液:精密量取100μg/mL内标阿奇霉素德糖胺标准贮备液0.6mL,于100mL容量瓶中,用0.05mol/L柠檬酸缓冲液(pH5.5)稀释至刻度,配成浓度为600μg/L的内标阿奇霉素德糖胺标准工作液。2~8℃保存,有效期1.5个月。
4.23 5%氨化乙腈溶液:取浓氨溶液5mL,加乙腈稀释至100mL。现用现配。
4.24 0.1%甲酸溶液:取甲酸1mL,加水稀释至1000mL。
4.25 0.1%甲酸乙腈溶液:取甲酸1mL,加乙腈稀释至1000mL。
4.26 0.1%甲酸溶液-乙腈混合液(80:20):取0.1%甲酸溶液80 mL与乙腈20 mL混合,即得。
5 仪器和设备
5.1 超高效液相色谱-串联质谱仪:配电喷雾离子源。
5.2 分析天平:感量0.00001g。
5.3 天平:感量0.01g。
5.4 组织匀浆机。
5.5 水浴锅。
5.6 振荡器。
5.7 旋涡混合器。
5.8 高速冷冻离心机。
5.9 固相萃取装置。
5.10 氮吹仪。
5.11 滤膜:0.2µm。
6 试料的制备与保存
6.1 试料的制备
取适量新鲜或解冻的空白或供试组织,绞碎,并使均质。
——取均质后的供试样品,作为供试试料。
——取均质后的空白样品,作为空白试料。
——取均质后的空白样品,添加适宜浓度的标准工作液,作为空白添加试料。
6.2 试料的保存
-20℃以下保存。
7 测定步骤
7.1提取
称取试料(1±0.02)g,置于50mL离心管中。对于添加回收样品,加入适量泰拉霉素标准工作液后旋涡1min(泰拉霉素与代谢物的对应关系是1.4:1),静置10min。加入2mol/L 盐酸溶液4mL,旋涡2min,300r/min振荡10min,60℃水浴消化1h。于4℃以5000r/min离心10min,收集上清液,下层加入2mol/L盐酸溶液3.5mL重复提取一次,合并上清液,加水定容至8mL。于4℃以10000r/min离心5min,取上清液0.5mL,加入600μg/L内标阿奇霉素德糖胺标准工作液25μL,加水4.5 mL,旋涡混匀备用。
7.2 净化
MCX固相萃取柱依次用乙腈3mL和水3mL活化,取备用液过柱,依次用0.1mol/L盐酸溶液3mL和甲醇3mL洗涤,5%氨化乙腈溶液5mL洗脱。洗脱液于50℃水浴氮气吹干,用0.1%甲酸溶液-乙腈混合液(80︰20)1.5mL复溶旋涡1min,以14000r/min离心20min,取上清液过0.2µm滤膜,供液相色谱-串联质谱测定。
7.3 基质匹配标准曲线的制备
取7份空白样品,经提取净化后,加入适量的泰拉霉素代谢物和内标阿奇霉素德糖胺的标准工作液,制得基质匹配标准溶液。猪肌肉组织对应样品添加浓度为5~2000μg/kg,其它组织对应样品添加浓度为5~1000μg/kg,供液相色谱-串联质谱测定。以测得泰拉霉素代谢物特征离子峰面积与内标阿奇霉素德糖胺特征离子峰面积之比作为纵坐标,对应的浓度为横坐标,绘制标准曲线。求线性回归方程和相关系数。
7.4 测定
7.4.1 液相色谱参考条件
色谱柱:BEHC18(50mm×2.1mm,粒径1.7μm),或相当者;
流动相:A:0.1%甲酸溶液;B:0.1%甲酸乙腈溶液。
柱温:40℃。
进样量:5µL。
梯度洗脱:梯度洗脱程序见表1。
表1 梯度洗脱程序
|
时间(min) |
流速(mL/min) |
流动相A(%) |
流动相B(%) |
|
0 |
0.4 |
98 |
2 |
|
0.5 |
0.4 |
98 |
2 |
|
1.5 |
0.4 |
60 |
40 |
|
2.0 |
0.4 |
60 |
40 |
|
2.5 |
0.4 |
1 |
99 |
|
3.0 |
0.4 |
1 |
99 |
|
3.1 |
0.4 |
98 |
2 |
|
4.5 |
0.4 |
98 |
2 |
7.4.2 质谱参考条件
离子源:电喷雾离子源。
扫描方式:正离子扫描。
检测方式:多反应监测。
电离电压:2.2kV。
源温:150℃。
雾化温度:500℃。
锥孔气流速:150L/h。
雾化气流速:1000L/h。
测试药物定性、定量离子对及对应的锥孔电压、碰撞能量见表2。
表2 泰拉霉素代谢物及内标阿奇霉素德糖胺的定性、定量离子对及锥孔电压、碰撞能量
|
化合物 |
离子对 (m/z) |
锥孔电压(V) |
碰撞能量(eV) |
|
泰拉霉素代谢物 |
577.5>116.0 |
90 |
28 |
|
577.5>158.0a |
90 |
28 |
|
|
内标阿奇霉素德糖胺 |
591.5>116.0 |
76 |
32 |
(a定量离子对)
7.4.3 测定法
7.4.3.1 定性测定
通过试样色谱图的保留时间与基质匹配标准溶液的保留时间、色谱峰的特征离子与基质匹配标准溶液色谱峰的特征离子相对照定性。试样与基质匹配标准溶液的保留时间的相对偏差不大于2.5%;试样特征离子的相对丰度与基质匹配标准溶液的相对丰度一致,相对丰度偏差不超过表3的规定,则可判断样品中存在相应的被测物。
表3 定性测定时相对离子丰度的最大允许偏差
|
相对离子丰度 |
>50% |
>20%至50% |
>10%至20% |
≤10% |
|
允许的相对偏差 |
±20% |
±25% |
±30% |
±50% |
7.4.3.2 定量测定
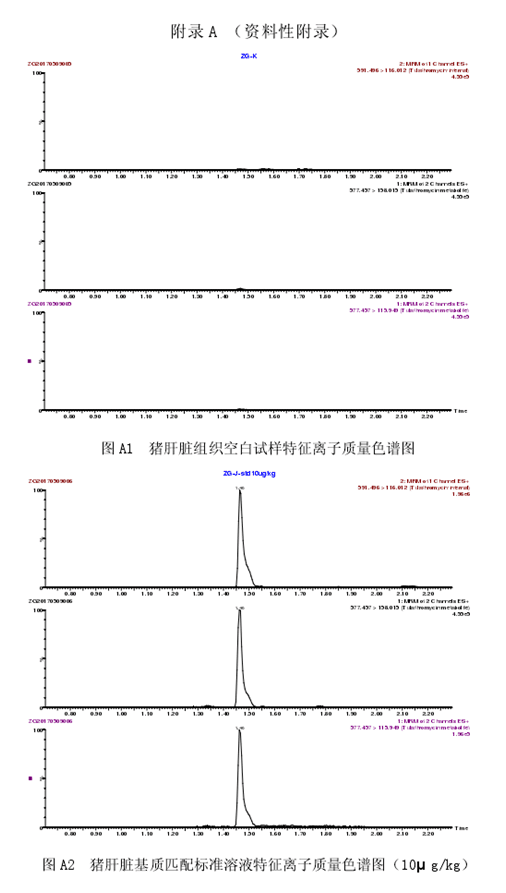
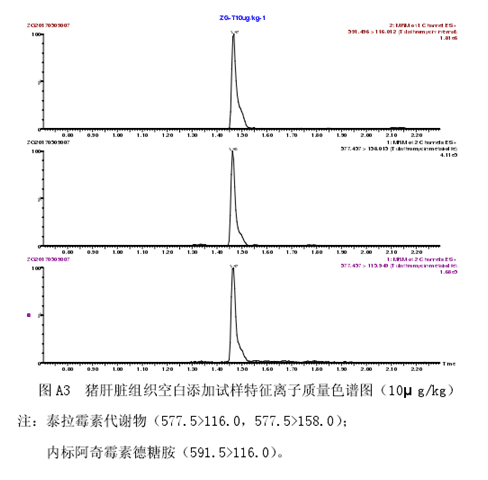
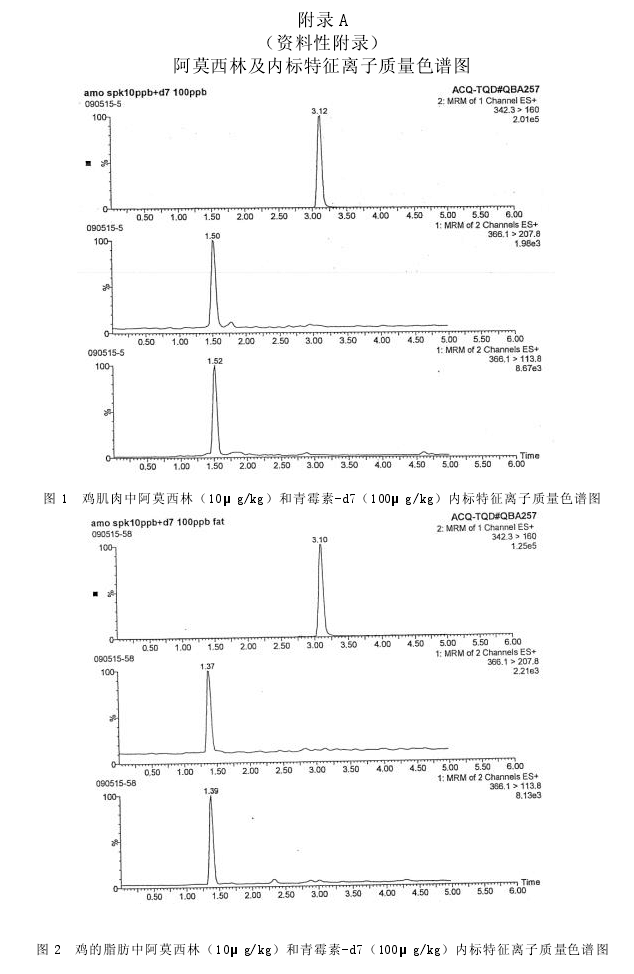
取试样溶液和相应的基质匹配标准工作液,按内标法定量,基质匹配标准工作液及试样溶液中的泰拉霉素代谢物的响应值均应在仪器检测的线性范围内。猪肝脏组织空白试样、猪肝脏基质匹配标准溶液以及猪肝脏组织空白添加试样的特征离子质量色谱图见附录A中图A1、图A2和图A3。
7.5 空白试验
除不加试料外,采用完全相同的步骤进行平行操作。
8 结果计算和表述
试料中泰拉霉素代谢物的残留量按下式计算:
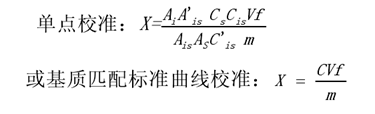
式中:
X——试料中泰拉霉素代谢物的残留量,μg/kg;
C——从标准曲线得到的泰拉霉素代谢物的浓度,μg/L;
Ai——试料溶液中泰拉霉素代谢物的峰面积;
A’is——基质匹配标准溶液中内标阿奇霉素德糖胺的峰面积;
Cs——基质匹配标准溶液中泰拉霉素代谢物的浓度,μg/L;
Cis——试料溶液中内标阿奇霉素德糖胺的浓度,μg/L;
Ais——试料溶液中内标阿奇霉素德糖胺的峰面积;
As——基质匹配标准溶液中泰拉霉素代谢物的峰面积;
C’is——基质匹配标准溶液中内标阿奇霉素德糖胺的浓度,μg/L;
V——试样最终定容体积,mL;
m——供试试料质量,g;
f——稀释倍数。
注:计算结果需扣除空白值,测定结果用平行测定的算术平均值表示,保留三位有效数字。
9 检测方法灵敏度、准确度和精密度
9.1 灵敏度
本方法的检测限为3μg/kg,定量限为10µg/kg。
9.2 准确度
本方法在猪肌肉组织中,10~1600µg/kg添加浓度水平上的回收率为70%~120%;在猪肝脏组织中,10~8000µg/kg添加浓度水平上的回收率为60%~120%;在猪肾脏组织中,10~16000µg/kg添加浓度水平上的回收率为70%~120%;在猪脂肪(皮+脂)组织中,10~600µg/kg添加浓度水平上的回收率为65%~120%;在牛肌肉组织中,10~600µg/kg添加浓度水平上的回收率为60%~120%;在牛肝脏组织中,10~9000µg/kg添加浓度水平上的回收率为60%~120%;在牛肾脏组织中,10~6000µg/kg添加浓度水平上的回收率为70%~120%;在牛脂肪组织中,10~400µg/kg添加浓度水平上的回收率为70%~120%。
9.3 精密度
本方法的批内相对标准偏差≤15%,批间相对标准偏差≤15%。
附件6
阿莫西林残留检测方法标准(试行)
动物性食品中阿莫西林残留检测 液相色谱-串联质谱法
1 范围
本标准规定了鸡肌肉和脂肪组织中阿莫西林残留量检测的制样和液相色谱-串联质谱测定方法。
本标准适用于鸡肌肉、脂肪组织中阿莫西林残留量的检测。
2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 1.1-2009 标准化工作导则 第1部分:标准的结构和编写规则
GB/T 6682 分析实验室用水规格和试验方法
3 原理
试料中残留的阿莫西林,经磷酸缓冲溶液提取并沉淀蛋白,经正己烷去除脂肪、固相萃取柱净化,使用液相色谱-串联质谱正离子模式测定,内标法定量。
4 试剂和材料
以下所用试剂,除特别注明外均为分析纯试剂;水为符合GB/T 6682规定的一级水
4.1 阿莫西林:含量≥98%;青霉素-d7:含量≥95%。
甲醇:色谱纯。
乙腈:色谱纯。
正己烷
甲酸
流动相A:0.1%甲酸乙腈。
流动相B:0.1%甲酸溶液。
4.8 磷酸盐缓冲液(pH 6.0):取磷酸二氢钾6.8g,加入1000mL去离子水溶解,用10mol/L的氢氧化钠溶液调节pH值至6.0。
4.9 磷酸盐缓冲液(pH 8.0):取磷酸二氢钾6.8g,加入1000mL去离子水溶解,用10mol/L的氢氧化钠溶液调节pH值至8.0。
4.10 阿莫西林标准贮备液(1.0mg/mL):精密称取相当于约10.00mg阿莫西林标准品,用水10mL溶解,即得。5℃下保存,有效期1个月。
4.11 阿莫西林标准工作液(10μg/mL):量取1.0mg/mL的阿莫西林标准贮备液100μL,用水稀释定容至10mL,即得。5℃下保存,有效期1个月。
4.12 青霉素-d7内标贮备液(1.0mg/mL):精密称重相当于约10.00mg青霉素-d7标准品,用水10mL溶解,即得。-20℃下保存,有效期1个月。
4.13 青霉素-d7内标工作液(10μg/mL):量取1.0mg/mL的青霉素-d7内标贮备液100μL,用水稀释定容至10mL,即得。现配现用。
5 仪器和设备
5.1 液相色谱-串联质谱仪:配有电喷雾离子源(ESI)。
5.2分析天平
5.3 可调式加液器(P20,P100,P1000,P5000)
5.4 固相萃取小柱:Oasis HLB, 3cc/60mg,或相当者。
5.5 涡旋混合器
5.6 振荡器
5.7 高速离心机
5.8 氮吹仪
5.9 超声波仪
5.10 滤膜:有机相,0.22μm。
6 试料的制备与保存
6.1 试料的制备
取适量新鲜或解冻的空白或供试组织,并使均质。
——取均质的供试样品,作为供试试料。
——取均质的空白样品,作为空白试料。
——取均质的空白样品,添加适宜浓度的标准工作液,作为空白添加试料。
6.2 试料的保存
-20℃以下保存。
7 测定步骤
7.1提取
称取试料(1±0.01)g于10mL 离心管中,添加10µg/mL青霉素-d7内标工作液适量,加磷酸缓冲液(肌肉pH 8.0,脂肪pH 6.0)4mL,涡混20秒,振荡提取5分钟。5℃下,8000r/min离心5分钟,转移上清液。在脂肪提取液中加入正己烷3mL,涡混20秒,振荡提取5分钟,5000r/min离心5min,弃去上层有机相,下层水相备用。
7.2净化
HLB固相萃取柱依次用甲醇2mL,水2mL,磷酸盐缓冲液(肌肉pH8.0,脂肪pH6.0)2mL活化。取提取液过柱,保持溶液以2~3mL/min通过SPE柱,依次用磷酸盐缓冲液(肌肉pH8.0,脂肪pH6.0)2mL,水4mL淋洗,真空抽干后,用甲醇3mL洗脱,收集洗脱液,在40℃氮气浓缩仪吹干,用0.5mL水复溶残余物,摇匀后,过0.22μm滤膜,供液相色谱-串联质谱测定。
7.3基质匹配标准溶液的制备
取空白试料,分别加入阿莫西林标准溶液和内标溶液,制成阿莫西林浓度为10,20,50,100,200,500,1000μg/kg以及内标溶液浓度为200μg/kg的空白添加样品,混匀,按提取和净化步骤操作,作为基质标准溶液,供液相色谱-串联质谱测定。以阿莫西林定量离子峰面积与青霉素-d7定量离子峰面积的比值为纵坐标,对应的基质标准溶液浓度为横坐标,绘制标准曲线。求回归方程和相关系数。
7.4测定
7.4.1色谱条件
色谱柱:C18(50×2.1mm,粒径1.7μm),或相当者;
流动相:A:0.1%甲酸乙腈;B:0.1%甲酸溶液;
流速:0.3mL/min;
进样量:10µL;
柱温:40℃;
流动相梯度及洗脱程序见表1。
表1 梯度洗脱程序(肌肉+脂肪)
|
时间min |
A% |
B% |
曲线 |
|
0 |
2 |
98 |
- |
|
2.0 |
20 |
80 |
6 |
|
4.5 |
40 |
60 |
1 |
|
6.0 |
2 |
98 |
1 |
7.4.2质谱条件
离子源:电喷雾离子源;
扫描方式:正离子扫描;
检测方式:多反应监测(MRM);
电离电压:3.0kV;
源温:120℃;
雾化温度:380℃;
锥孔气流速:50L/h;
雾化气流速:500L/h;
测试药物定性、定量离子对及对应的锥孔电压、碰撞能量见表2。
表2 阿莫西林和青霉素-d7的定量离子对及锥孔电压、碰撞能量
|
目标化合物 |
定性离子对m/z |
定量离子对m/z |
锥孔电压/V |
碰撞能量(eV) |
|
阿莫西林 |
366.1>207.8 366.1>113.8 |
366.1>113.8 |
18 |
14 |
|
20 |
||||
|
青霉素-d7 |
342.3>160.0 |
342.3>160.0 |
30 |
22 |
7.4.3测定法
取试料溶液和基质匹配标准溶液,作单点或多点校准,内标法计算。试样溶液和基质匹配标准溶液中阿莫西林和内标的特征离子质量色谱峰面积均应在仪器检测的线性范围之内。试样溶液中的离子相对丰度与基质匹配标准溶液中的离子相对丰度相比,符合表3的要求。标准溶液和添加试液中特征离子质量色谱图见附录A。
表3 定性测定时相对离子丰度的最大允许偏差
|
相对离子丰度 % |
>50 |
>20~50 |
>10~20 |
≤10 |
|
允许的相对偏差 % |
±20 |
±25 |
±30 |
±50 |
7.5空白试验
除不加试料外,采用完全相同的步骤进行平行操作。
8 结果计算和表述
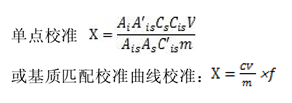
式中:
Cis—试样溶液中相应青霉素-d7内标的浓度,μg/L;
C—从标准曲线得到的相应阿莫西林的浓度,μg/L;
C’is—对照溶液中相应青霉素-d7内标的浓度,μg/L;
Cs—对照溶液中相应阿莫西林的浓度,μg/L;
Ais—试样溶液中相应青霉素-d7内标的峰面积;
Ai—试样溶液中相应阿莫西林的峰面积;
A’is—对照溶液中相应青霉素-d7内标的峰面积;
As—对照溶液中相应阿莫西林的峰面积;
X—试样中相应阿莫西林的残留量,μg/kg;
V—试样定容体积,mL;
m—供试试料质量,g。
f—稀释倍数
注:计算结果需扣除空白值,测定结果用平行测定的算术平均值表示,保留三位有效数字。
9 检测方法的灵敏度、准确度和精密度
9.1 灵敏度
本方法阿莫西林的定量限为10μg/kg。
9.2 准确度
本方法阿莫西林在10µg/kg~100µg/kg添加浓度水平上的回收率为70%~110%。
9.3 精密度
本方法批内和批间相对标准偏差均≤15%。
相关新闻
- 农业农村部办公厅关于印发《无非洲猪瘟区标准》和《无规定动物疫病小区管理技术规范》的通知 2020-04-14
- 中华人民共和国农业农村部公告第197号 2020-01-09
- 中华人民共和国农业农村部公告 第110号 2019-01-20
- 中华人民共和国农业部公告第2377号 2016-04-20
- 农业部关于印发《动物疫情监测与防治经费 项目资金管理办法》的通知 2017-12-20



 提示信息
提示信息