中华人民共和国农业农村部公告第283号
根据《兽药管理条例》和《兽药注册办法》规定,经审查,批准法国维克有限公司(VIRBAC)等2家公司生产的注射用盐酸替来他明盐酸唑拉西泮等2种兽药产品在我国再注册,核发《进口兽药注册证书》,并发布修订后的产品质量标准、说明书和标签,自发布之日起执行。此前发布的前述产品兽药质量标准、说明书和标签同时废止。
批准美国礼蓝动物保健有限公司美国生产厂生产的莫能菌素预混剂在我国再注册,核发《进口兽药注册证书》,并发布修订后的产品质量标准、说明书和标签以及残留检测方法标准(试行),自发布之日起执行。此前发布的该产品兽药质量标准、说明书和标签同时废止。
特此公告。
附件:1.进口兽药注册目录
2.质量标准
3.说明书和标签
4.莫能菌素残留检测方法标准(试行)
农业农村部
2020年03月23日
附件
进口兽药注册目录
|
兽药名称 |
生产厂名称 |
国别 |
进口兽药注册证书号 |
有效期限 |
备注 |
|
注射用盐酸替来他明盐酸唑拉西泮 (替来他明125mg+唑拉西泮125mg) TiletamineHydrochlorideandZolazepamHydrochlorideforInjection (Tiletamine125mg+Zolazepam125mg) |
法国维克有限公司 VIRBAC |
法国 |
(2020) 外兽药证字 06号 |
2020.03.23 - 2025.03.22 |
再注册 |
|
注射用盐酸替来他明盐酸唑拉西泮 (替来他明250mg+唑拉西泮250mg) TiletamineHydrochlorideandZolazepamHydrochlorideforInjection (Tiletamine250mg+Zolazepam250mg) |
(2020) 外兽药证字 07号 |
||||
|
莫能菌素预混剂 MonensinPremix |
美国礼蓝动物保健有限公司美国 生产厂 ElancoClintonLaboratories |
美国 |
(2020) 外兽药证字 08号 |
2020.03.23 - 2025.03.22 |
再注册 |
|
鸡马立克氏病活疫苗(CVI988株) Marek’sDiseaseVaccine,Live (StrainCVI988) |
勃林格殷格翰动物保健(美国)有限公司(Gainesville生产厂) BoehringerIngelheimAnimalHealthUSAInc. |
美国 |
(2020) 外兽药证字 09号 |
2020.03.23 - 2025.03.22 |
再注册 |
附件2略
附件3
注射用盐酸替来他明盐酸唑拉西泮等3种兽药产品
说明书和标签
一、注射用盐酸替来他明盐酸唑拉西泮说明书和标签
(一)注射用盐酸替来他明盐酸唑拉西泮说明书
宠物用
【兽药名称】
通用名称:注射用盐酸替来他明盐酸唑拉西泮
商品名称:舒泰®50、舒泰®100(Zoletil®50,Zoletil®100)
英文名称:TiletamineHydrochlorideandZolazepamHydrochlorideforInjection
汉语拼音:ZhusheyongYansuanTilaitamingYansuanZuolaxipan
【主要成分】盐酸替来他明、盐酸唑拉西泮
【性状】本品为白色至淡黄色结晶性冻干粉末。
【药理作用】药效学本品为复方麻醉剂。盐酸替来他明和盐酸唑拉西泮的作用机制可以互相补充。替来他明是一种分离麻醉剂,其药理作用与氯胺酮类似;唑拉西泮为苯二氮䓬类镇静催眠药,药理作用与安定类似,具有抗焦虑、镇静、抗惊厥和肌肉松弛作用。唑拉西泮可加强替来他明对中枢神经系统的抑制作用,同时又可防止由替来他明引起的惊厥,增强肌肉松弛效果,还可缩短麻醉苏醒时间。本品能迅速使肌肉松弛,引起浅表性痛觉和内脏的痛觉消失,并且不引起呼吸中枢抑制。具有镇静、镇痛和麻醉作用。
药动学犬、猫肌肉注射10mg/kg体重后,替来他明和唑拉西泮的血药浓度30分钟内达到高峰。麻醉持续时间为20~60分钟。替来他明的半衰期:犬为75分钟,猫为150分钟;唑拉西泮的半衰期:犬为60分钟,猫为270分钟。
药物相互作用1.与酚噻嗪(乙酰丙嗪、氯丙嗪)合用,可增加心脏抑制、呼吸功能抑制和体温降低的风险。
2.氯霉素会降低麻醉药的代谢率。
【适应证】用于犬、猫的保定和全身麻醉。
【用法与用量】使用前用包装内无菌注射用水溶解固体瓶内粉末。
术前用药:在注射本品15分钟前使用硫酸阿托品,皮下注射:每1kg体重,犬0.1mg,猫0.05mg。
全身麻醉:首次剂量,肌肉注射:每1kg体重,犬7~25mg,猫10~15mg。或静脉注射:每1kg体重,犬5~10mg,猫5~7.5mg。
维持剂量:为首次剂量的1/3~1/2,最好采用静脉注射。
【不良反应】与其他麻醉药一样,使用中可能出现的不良反应与动物个体的健康状况、年龄、给药剂量和持续时间有关。可能出现的不良反应包括:
1.诱导综合征:如心肺衰竭、气管分泌物增加、呕吐等。
2.麻醉后综合征:如苏醒时间延长、体温调节障碍、胃扩张等。
3.过敏反应。
【禁忌症】
1.接受系统性有机磷氨基甲酸盐类杀虫治疗的犬猫。
2.患有严重心脏病或呼吸系统缺陷的犬猫。
3.胰腺缺陷的动物。
4.患有严重高血压的犬猫。
【注意事项】
1.在兽医指导下使用。
2.实施麻醉前禁食12小时。
3.确保犬猫在安静和凉暗的环境下苏醒。
4.注意犬猫保温,防止热量散失过多。
5.本品稀释后,室温避光保存48小时或2~8℃避光保存8日。
【规格】(1)替来他明125mg+唑拉西泮125mg(2)替来他明250mg+唑拉西泮250mg
【贮藏】遮光,密闭保存。
【有效期】24个月。
【进口兽药注册证号】
【生产企业】法国维克有限公司(VIRBAC)
地址:1EREAVENUE2065MLID,06510CARROS,FRANCE
(二)注射用盐酸替来他明盐酸唑拉西泮标签
宠物用
【兽药名称】
通用名称:注射用盐酸替来他明盐酸唑拉西泮
商品名称:舒泰®50、舒泰®100(Zoletil®50,Zoletil®100)
英文名称:TiletamineHydrochlorideandZolazepamHydrochlorideforInjection
汉语拼音:ZhusheyongYansuanTilaitamingYansuanZuolaxipan
【主要成分】盐酸替来他明、盐酸唑拉西泮
【性状】本品为白色至淡黄色结晶性冻干粉末。
【适应证】用于犬、猫的保定和全身麻醉。
【用法与用量】使用前用包装内无菌注射用水溶解固体瓶内粉末。(详见说明书)。
【规格】(1)替来他明125mg+唑拉西泮125mg(2)替来他明250mg+唑拉西泮250mg
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【贮藏】遮光,密闭保存。
【生产企业】法国维克有限公司(VIRBAC)
地址:1EREAVENUE2065MLID,06510CARROS,FRANCE
二、莫能菌素预混剂说明书和标签
(一)莫能菌素预混剂说明书
兽用
【兽药名称】
通用名称:莫能菌素预混剂
商品名称:欲可胖®200(Elancoban®200)
英文名称:MonensinPremix
汉语拼音:MonengjunsuYuhunji
【主要成分】莫能菌素
【性状】本品为黄褐色粉末。
【药理作用】抗生素类药。本品为广谱抗球虫药,对鸡柔嫩、毒害、巨型、和缓、布氏和堆型艾美耳球虫都有效。莫能菌素与钠、钾离子有特殊的亲和力,可形成亲脂性络合物,透过球虫生物膜,使球虫体内钠离子量急剧增加,妨碍离子的正常平衡和运转,球虫体内过剩的钠离子不能排出,最后使虫体膨胀而死亡。此外,莫能菌素能调节瘤胃微生物发酵类型,提高发酵物中丙酸的比例,从而提高饲料的能量利用率;节省离子在组织和细胞间运输的能量消耗;抑制瘤胃微生物产生乳酸的活性,从而防止高精料育肥的情况下可能发生的酸中毒。
【适应证】用于防治鸡球虫病;辅助缓解奶牛酮病症状,提高产奶量。
【用法与用量】以莫能菌素计。混饲:每1000kg饲料,鸡90~110g。奶牛(泌乳期添加),一日量,每头150~450mg。
【不良反应】
1.饲料中添加量超过120mg/kg时,可引起鸡增长率和饲料转化率下降。
2.超剂量使用莫能菌素时,可导致牛增重率下降,甚至中毒死亡。
3.饲喂前必须将莫能菌素与饲料混匀,禁止直接饲喂未经稀释的莫能菌素。
【注意事项】
1.10周龄以上火鸡、珍珠鸡及鸟类对本品较敏感,不宜应用;超过16周龄的鸡禁用。
2.马属动物禁用。
3.禁止与泰妙菌素、竹桃霉素同时使用,以免发生中毒。
4.搅拌配料时防止与人的皮肤、眼睛接触。
5.蛋鸡产蛋期禁用。
6.可在商品饲料和养殖过程中使用。
【休药期】鸡5日。
【规格】100g∶20g(2000万单位)
【包装】
【贮藏】密闭,在干燥处保存。
【有效期】24个月。
【进口兽药注册证号】
【生产企业】美国礼蓝动物保健有限公司美国生产厂(ElancoClintonLaboratories)
地址:10500SouthStateRoad63,Clinton,Indiana,47842-0099,U.S.A.
(二)莫能菌素预混剂标签
兽用
【兽药名称】
通用名称:莫能菌素预混剂
商品名称:欲可胖®200(Elancoban®200)
英文名称:MonensinPremix
汉语拼音:MonengjunsuYuhunji
【主要成分】莫能菌素
【性状】本品为黄褐色粉末。
【适应证】用于防治鸡球虫病;辅助缓解奶牛酮病症状,提高产奶量。
【用法与用量】以莫能菌素计。混饲:每1000kg饲料,鸡90~110g。奶牛(泌乳期添加),一日量,每头150~450mg。
【规格】100g∶20g(2000万单位)
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【休药期】鸡5日;蛋鸡产蛋期禁用。
【贮藏】密闭,在干燥处保存。
【包装】
【生产企业】美国礼蓝动物保健有限公司美国生产厂(ElancoClintonLaboratories)
地址:10500SouthStateRoad63,Clinton,Indiana,47842-0099,U.S.A.
三、鸡马立克氏病活疫苗(CVI988株)说明书和标签
(一)鸡马立克氏病活疫苗(CVI988株)说明书
兽用
通用名鸡马立克氏病活疫苗(CVI988株)
商品名
英文名Marek'sDiseaseVaccine,Live(StrainCVI988)
汉语拼音JiMalikeshibingHuoyimiao(CVI988Zhu)
【主要成分与含量】每羽份疫苗含鸡马立克氏病病毒(CVI988株)至少2000PFU。
【性状】均一淡红色细胞悬液。
【作用与用途】用于接种1日龄雏鸡,预防鸡马立克氏病。
【用法与用量】雏鸡颈背部皮下注射。每次从液氮罐中取出1安瓿疫苗,置20~30℃水中,使疫苗快速解冻。用无菌注射器将解冻的疫苗慢慢注入适量的稀释液中(每1000羽份疫苗用200ml无菌稀释液稀释),通过旋转或倒转容器使疫苗液充分混匀,切勿剧烈振荡。每只0.2ml。针头不可伤及颈部肌肉或骨头。
【不良反应】一般无可见的不良反应。
【注意事项】(1)应将接种器械于121℃高压灭菌至少15分钟或置沸水浴中消毒至少20分钟。不要让接种器械接触化学消毒剂。
(2)本品仅用于接种健康雏鸡。
(3)在接种过程中或接种后,应避免使鸡群处于应激状态。
(4)疫苗开瓶后应一次用完。
(5)用过的疫苗瓶、器具和未用完的疫苗等应进行无害化处理。
(6)屠宰前21日内禁止使用。
【规格】(1)1000羽份/瓶(2)2000羽份/瓶
【贮藏与有效期】在液氮中保存,有效期为18个月。
【《进口兽药登记许可证》证号】
【生产企业】勃林格殷格翰动物保健(美国)有限公司(Gainesville生产厂)(BoehringerIngelheimAnimalHealthUSAInc.)
地址:1168AirportParkway,SW,Gainesville,GA30501,USA
仅在兽医指导下使用
(二)鸡马立克氏病活疫苗(CVI988株)标签
兽用
鸡马立克氏病活疫苗(CVI988株)
1000(2000)羽份/瓶《进口兽药登记许可证》证号:
批号:
有效期至:
【生产企业】勃林格殷格翰动物保健(美国)有限公司(Gainesville生产厂)(BoehringerIngelheimAnimalHealthUSAInc.)
仅在兽医指导下使用
附件4
莫能菌素残留检测方法标准(试行)
鸡和牛可食性组织中莫能菌素残留量的测定
液相色谱-串联质谱法(试行)
1.范围
本标准规定了鸡和牛可食性组织中莫能菌素残留量检测的制样和液相色谱-串联质谱测定方法。
本标准适用于鸡的肌肉、肝脏、肾脏、皮+脂,牛的肌肉、肝脏、肾脏、脂肪中莫能菌素残留量的检测。
2.规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T6682分析实验室用水规格和试验方法
3.原理
试料中的莫能菌素用异辛烷-乙酸乙酯混合液提取,硅胶固相萃取柱净化后,用液相色谱-串联质谱法测定,内标法定量。
4.试剂和材料
以下所用的试剂,除特别注明外均为分析纯试剂;水为符合GB/T6682规定的一级水。
4.1莫能菌素、尼日利亚菌素标准品:纯度≥95%。
4.2乙腈:色谱纯。
4.3甲醇:色谱纯。
4.4正己烷:色谱纯。
4.5乙酸乙酯:色谱纯。
4.6异辛烷:色谱纯。
4.7甲酸:色谱纯。
4.8碳酸氢钠。
4.9无水硫酸钠。
4.10中性甲醇:取1000mL甲醇,加入1gNaHCO3,充分混合,静置后取上清液使用,如果浑浊则用11µm滤纸过滤后使用。
4.11提取溶剂:取4500mL异辛烷,加入500mL乙酸乙酯,混匀。
4.12硅胶固相萃取柱淋洗溶剂:取500mL乙酸乙酯,加入500mL正己烷,混匀。
4.13硅胶固相萃取柱洗脱溶剂:取800mL乙酸乙酯,加入200mL甲醇,混匀。
4.140.1%甲酸水溶液:取1000mL超纯水,加入1mL甲酸,混匀,必要时过滤。
4.150.1%甲酸乙腈溶液:取5000mL乙腈,加入5mL甲酸,混匀,必要时过滤。
4.16莫能菌素标准储备液(1mg/mL):准确称取含10mg莫能菌素的标准品,于10mL容量瓶中,用甲醇溶解并稀释至刻度,配制成浓度约为1mg/mL的标准储备液。-20℃保存,有效期3个月。
4.17莫能菌素中间标准工作液(10µg/mL):准确移取适量莫能菌素标准储备液(1mg/mL),用中性甲醇稀释,配制成浓度为10µg/mL的中间标准工作液。2~8℃保存,有效期1个月。
4.18尼日利亚菌素内标储备液(0.5mg/mL):准确称取含5mg尼日利亚菌素标准品,于10mL容量瓶中,用甲醇溶解并稀释至刻度,配制成浓度约为0.5mg/mL的标准储备液。-20℃保存,有效期3个月。
4.19尼日利亚菌素添加内标工作液(2.5µg/mL):准确移取适量内标储备液(0.5mg/mL),用乙酸乙酯稀释,配制成浓度为2.5µg/mL的添加内标工作液。2~8℃保存,有效期1个月。
4.20尼日利亚菌素校准内标工作液(2.5µg/mL):准确移取适量内标储备液(0.5mg/mL),用中性甲醇稀释,配制成浓度为2.5µg/mL的校准内标工作液。2~8℃保存,有效期1个月。
5.仪器和设备
5.1液相色谱-串联质谱仪:配电喷雾离子源(ESI源)。
5.2分析天平:感量0.00001g。
5.3天平:感量0.01g。
5.4组织匀浆机。
5.5高速冷冻离心机。
5.6涡旋混合器。
5.7振荡器。
5.8氮吹仪。
5.9固相萃取装置。
5.10水浴超声波。
5.11硅胶固相萃取柱:500mg-6mL或相当者。
5.12钢珠:10mm。
6.试料的制备与保存
6.1试料的制备
取适量新鲜或解冻的空白或供试组织,绞碎,并使均质。
——取均质的供试样品,作为供试试料。
——取均质的空白样品,作为空白试料。
——取均质的空白样品,添加由乙酸乙酯稀释的适宜浓度莫能菌素标准溶液,作为空白添加试料。
6.2试料的保存
-20℃以下保存。
7.测定步骤
7.1提取
称取试料5(±0.05)g,置于50mL离心管中,加入200µL尼日利亚菌素添加内标工作液(2.5µg/mL),涡旋混合后静置30min。
7.1.1肝脏、肾脏和肌肉组织的提取
向试料中加入15mL提取溶剂和4个直径为10mm的钢球,在振荡器中,中速混合5min。于5000r/min和4℃条件下离心5min,移取上清液,于另一50mL刻度离心管中。向残渣中加入15mL提取溶剂,重复提取一次,合并2次上清液,用提取溶剂定容至30mL。加入2.0g无水Na2SO4,涡旋混合5min,于5000r/min和4℃条件下离心5min,取上清液作为备用液。
7.1.2脂肪组织的提取
向试料中加入15mL提取溶剂和4个直径为10mm的钢球,在振荡器中,中速混合5min,然后在2~8℃条件下冷藏15min。于8000r/min和20℃条件下离心10min,移取上清液,于另一50mL刻度离心管中。向残渣中加入15mL提取溶剂,重复提取一次,合并2次上清液,用提取溶剂定容至30mL。加入2.0g无水Na2SO4,涡旋混合5min,在2~8℃条件下冷藏30min,8000r/min和4℃条件下离心5min,取上清液作为备用液。
7.2净化
取硅胶固相萃取柱,加入1.0g无水Na2SO4,分别用甲醇6mL、乙酸乙酯5mL和提取溶剂5mL活化,取备用液6mL过柱,控制流速约2mL/min,依次用5mL正己烷、3mL淋洗溶剂淋洗,再用8mL洗脱溶剂洗脱;收集洗脱液,于35~40℃水浴中吹干,用中性甲醇1.0mL溶解残余物,涡旋混合15s,超声处理2min,再次涡旋混合,供液相色谱-串联质谱测定。对于脂肪提取物,在8000r/min和4℃条件下离心5min后用于测定。
7.3基质匹配标准曲线制备
取莫能菌素中间标准工作液(10µg/mL)适量,用中性甲醇稀释成浓度分别为2.5、5、20、50、100、200、500、1000、2000ng/mL的系列莫能菌素标准溶液,精密移取上述莫能菌素标准溶液各1mL,同时加入尼日利亚菌素校准内标工作液(2.5µg/mL)400µL,用中性甲醇稀释至10mL,混匀,分别移取1mL溶解由相应空白组织经样品前处理后获得的氮气吹干残余物,涡旋混合15s,超声处理2min,并再次涡旋混合,制成浓度分别为0.25、0.5、2、5、10、20、50、100、200ng/mL的基质匹配标准溶液。供液相色谱-串联质谱测定。以测得的莫能菌素特征离子峰面积与尼日利亚菌素特征离子峰面积之比作为纵坐标,对应的浓度为横坐标,绘制标准曲线。求线性回归方程和相关系数。
7.4测定
7.4.1色谱参考条件
a)色谱柱:ZORBAXEclipseXDB-C18,4.6×50mm,3.5μm或相当者。
b)流动相:A相为0.1%甲酸水溶液;B相为0.1%甲酸乙腈溶液,A+B=5+95(v/v)。
c)流速:0.8mL/min。
d)柱温:40℃。
e)进样量:5µL。
7.4.2质谱参考条件
a)离子源:电喷雾离子源。
b)扫描方式:正离子扫描。
c)检测方式:多反应监测。
d)碰撞气压力(CAD):Medium。
e)气帘气压力(CUR):30psi。
f)雾化气压力(GS1):50psi。
g)辅助加热气压力(GS2):60psi。
h)离子源喷雾电压(IS):5500V。
i)碰撞池出口电压(CXP):13V。
j)离子源温度(TEM):500℃。
待测物及内标定性离子对、定量离子对、去簇电压、碰撞能量见表1。
表1待测物及内标定性离子对、定量离子对及对应的去簇电压和碰撞能量
|
化合物 |
离子对(m/z) |
去簇电压 DP(V) |
碰撞能量 CE(V) |
|
莫能菌素 |
693.5>675.5a |
60 |
49 |
|
693.5>479.4 |
67 |
||
|
尼日利亚菌素(内标) |
747.6>729.6 |
60 |
57 |
(a定量离子)
7.5测定法
7.5.1定性测定
通过样品的保留时间与基质匹配标准溶液的保留时间、各色谱峰的特征离子与基质匹配标准溶液色谱峰的特征离子相对照定性。样品与基质匹配标准溶液的保留时间的相对偏差不大于2.5%;样品特征离子的相对丰度与基质匹配标准溶液的相对丰度一致,相对丰度偏差不超过表2的规定,则可判断样品中存在相应的被测物。
表2定性测定时相对离子丰度的最大允许偏差
|
相对离子丰度 |
˃50% |
˃20%至50% |
˃10%至20% |
≤10% |
|
允许的相对偏差 |
±20% |
±25% |
±30% |
±50% |
7.5.2定量测定
取试样溶液和相应的基质匹配标准溶液,按内标法定量,标准溶液及试样溶液中莫能菌素的响应值均应在仪器检测的线性范围内。
7.6空白试验
除不加试料外,采用完全相同的步骤进行平行操作。
8.结果计算和表达
单点校准: ……………………(1)
……………………(1)
或标准曲线校准:由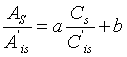 求得
求得![]() 和
和![]() ,则
,则
 …………………(2)
…………………(2)
按下式(3)计算试料中莫能菌素残留量:
 …………(3)
…………(3)
式中:
![]() ——试样溶液中莫能菌素的浓度,单位为纳克每毫升(ng/mL);
——试样溶液中莫能菌素的浓度,单位为纳克每毫升(ng/mL);
X——试料中莫能菌素的残留量,单位为微克每千克(µg/kg);
A——试样溶液中莫能菌素的峰面积;
A’is——基质匹配标准溶液中尼日利亚菌素的峰面积;
Cs——基质匹配标准溶液中莫能菌素的浓度,单位为纳克每毫升(ng/mL);
Cis——试样溶液中尼日利亚菌素的浓度,单位为纳克每毫升(ng/mL);
Ais——试样溶液中尼日利亚菌素的峰面积;
As——基质匹配标准溶液中莫能菌素的峰面积;
C’is——基质匹配标准溶液中尼日利亚菌素的浓度,单位为纳克每毫升(ng/mL);
V1——备用液总体积,单位为毫升(mL);
V2——过柱备用液体积,单位为毫升(mL);
V3——最终定容体积,单位为毫升(mL);
m——称样量,单位为克(g);
f——稀释倍数。
注:计算结果需扣除空白值,测定结果用平行测定的算术平均值表示,保留三位有效数字。
9.检测方法灵敏度、准确度和精密度
9.1灵敏度
本方法在鸡的肌肉、肝脏、肾脏、皮+脂,牛的肌肉、肝脏、肾脏、脂肪中莫能菌素检测限均为0.25μg/kg,定量限均为0.5μg/kg。
9.2准确度
本方法对鸡肌肉、鸡肝脏、鸡肾脏、牛肌肉和牛肾脏在0.5~20µg/kg添加浓度水平,鸡皮+脂、牛肝脏、牛脂肪在0.5~200µg/kg添加浓度水平,莫能菌素的回收率均为60%~120%。
9.3精密度
本方法批内相对标准偏差≤20%,批间相对标准偏差≤20%。
附录A
(资料性附录)
莫能菌素特征离子质量色谱图
![]()
![]()
![]()

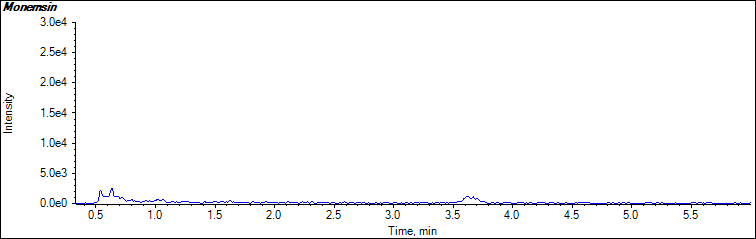

说明:1-莫能菌素特征离子质量色谱图(693.5>675.5)
2-莫能菌素特征离子质量色谱图(693.5>479.4)
3-尼日利亚菌素特征离子质量色谱图(747.6>729.6)
图1牛肝空白样品特征离子质量色谱图
![]()
![]()
![]()


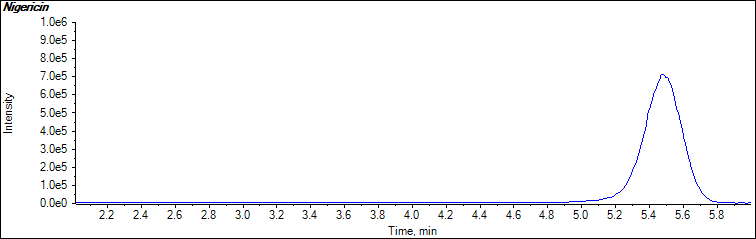
说明:1-莫能菌素特征离子质量色谱图(693.5>675.5)
2-莫能菌素特征离子质量色谱图(693.5>479.4)
3-尼日利亚菌素特征离子质量色谱图(747.6>729.6)
图2牛肝基质匹配标准溶液特征离子质量色谱图(0.5μg/kg)
![]()
![]()



![]() 说明:1-莫能菌素特征离子质量色谱图(693.5>675.5)
说明:1-莫能菌素特征离子质量色谱图(693.5>675.5)
2-莫能菌素特征离子质量色谱图(693.5>479.4)
3-尼日利亚菌素特征离子质量色谱图(747.6>729.6)
图3牛肝添加样品特征离子质量色谱图(0.5μg/kg)
相关新闻
- 中华人民共和国农业农村部公告第469号 2021-12-07
- 中华人民共和国农业农村部公告第474号 2021-12-07
- 中华人民共和国农业农村部公告第355号 2021-01-29
- 中华人民共和国农业农村部公告第344号 2020-12-20
- 中华人民共和国农业农村部公报第332号 2020-11-30



 提示信息
提示信息