中华人民共和国农业农村部公告第301号
根据《兽药管理条例》和《兽药注册办法》规定,经审查,批准勃林格殷格翰动物保健有限公司意大利生产厂(Boehringer Ingelheim Animal Health Italia S.P.A)等4家公司生产的禽病毒性关节炎油乳剂灭活疫苗等5种兽药产品在我国再注册,核发《进口兽药注册证书》,并发布修订后的产品质量标准、说明书和标签,自发布之日起执行。此前发布的前述产品兽药质量标准、说明书和标签同时废止。
批准KVP Kiel有限责任公司生产的恩诺沙星注射液在我国再注册及变更注册,核发《进口兽药注册证书》,并发布修订后的产品质量标准、说明书和标签以及残留检测方法标准(试行),自发布之日起执行。此前发布的前述产品兽药质量标准、说明书和标签同时废止。
批准勃林格殷格翰动物保健(美国)有限公司等2家公司生产的鸡传染性法氏囊病复合冻干活疫苗(2512株)等2种兽药产品在我国变更注册。特此公告。
附件:1.进口兽药注册目录
2.质量标准
3.说明书和标签
4.恩诺沙星残留检测方法标准(试行)
农业农村部
2020年5月19日
附件1
进口兽药注册目录
|
兽药名称 |
生产厂名称 |
国 别 |
进口兽药 注册证书号 |
有效期限 |
备注 |
|
禽病毒性关节炎油乳剂灭活疫苗 (Olson WVU2937株) Infectious Arthritis Vaccine,Inactivated(Strain Olson WVU2937) |
勃林格殷格翰动物保健有限公司意大利生产厂 Boehringer Ingelheim Animal Health Italia S.p.A |
意大利 |
(2020) 外兽药证字 13号 |
2020.05.19 — 2025.05.18 |
再注册 |
|
托芬那酸注射液 (10ml:0.4g) Tolfenamic Acid Injection (10ml:0.4g) |
法国威隆制药股份有限公司 Vetoquinol S.A. |
法国 |
(2020) 外兽药证字 14号 |
2020.05.19 — 2025.05.18 |
再注册 |
|
托芬那酸注射液 (30ml:1.2g) Tolfenamic Acid Injection (30ml:1.2g) |
(2020) 外兽药证字 15号 |
||||
|
猪伪狂犬病灭活疫苗 (Bartha K61株) Swine Pseudorabies Vaccine,Inactivated(Strain Bartha K61) |
西班牙海博莱生物大药厂 LABORATORIOS HIPRA,S.A. |
西班牙 |
(2020) 外兽药证字 16号 |
2020.05.19 — 2025.05.18 |
再注册 |
|
右旋糖酐铁注射液 (100ml:20g) Iron Dextran Injection (100ml:20g) |
法国维克有限公司 Virbac |
法国 |
(2020) 外兽药证字 17号 |
2020.05.19 — 2025.05.18 |
再注册 |
|
马波沙星片 (5mg) Marbofloxacin Tablets (5mg) |
法国威隆制药股份有限公司 Vetoquinol S.A. |
法国 |
(2020) 外兽药证字 18号 |
2020.05.19 — 2025.05.18 |
再注册 |
|
马波沙星片 (20mg) Marbofloxacin Tablets (20mg) |
(2020) 外兽药证字 19号 |
||||
|
马波沙星片 (80mg) Marbofloxacin Tablets (80mg) |
(2020) 外兽药证字 20号 |
||||
|
恩诺沙星注射液(100ml:5g)Enrofloxacin Injection (100ml:5g) |
KVP Kiel有限责任公司 KVP Pharma + Veterinär Produkte GmbH |
德国 |
(2020) 外兽药证字 21号 |
2020.05.19 — 2025.05.18 |
再注册、变更注册:修改注册质量标准及变更兽药有效期 |
|
恩诺沙星注射液(100ml:10g)Enrofloxacin Injection (100ml:10g) |
(2020) 外兽药证字 22号 |
||||
|
鸡传染性法氏囊病复合冻干活疫苗 (2512株)Infectious Bursal Disease Vaccine,Live Freeze-dried Complex (Strain 2512) |
勃林格殷格翰动物保健(美国)有限公司 (Gainesville 生产厂) Boehringer Ingelheim Animal Health USA Inc. |
美国 |
(2018) 外兽药证字35号 |
2020.05.19 — 2023.08.29 |
变更注册,增加包装(1)2000羽份/瓶:10瓶/盒(2)8000羽份/瓶:10瓶/盒 |
|
地克珠利混悬液 Diclazuril Suspension |
Lusomedicamenta药业技术有限公司 Lusomedicamenta- Technical Pharmaceutical Society.,A.S. |
葡萄牙 |
(2016) 外兽药证字01号 |
2020.05.19 — 2021.01.26 |
变更注册:增加原料药产地:江苏常州齐辉药业有限公司 |
附件2 略
附件3
禽病毒性关节炎油乳剂灭活疫苗(Olson WVU2937株)
等6种兽药产品说明书和标签
一、 禽病毒性关节炎油乳剂灭活疫苗(Olson WVU2937株)说明书和内包装标签
(一)禽病毒性关节炎油乳剂灭活疫苗(Olson WVU2937株)说明书
【兽药名称】
兽用
通用名 禽病毒性关节炎油乳剂灭活疫苗(Olson WVU2937株)
商品名 无
英文名 Avian Viral Arthritis Vaccine, Inactivated(Strain Olson WVU2937)
汉语拼音 Qin Bingduxingguanjieyan Youruji Miehuoyimiao(Olson WVU2937 Zhu)
【主要成分与含量】 含灭活的禽病毒性关节炎病毒Olson WVU2937株,灭活前的滴度至少为107.0 TCID50/羽份。
【性状】 白色均匀乳剂。
【作用与用途】 用于预防鸡病毒性关节炎。
【用法与用量】 皮下或肌肉注射,每只0.5 ml。
【不良反应】 在接种部位可见短时间的轻微肿胀。
【注意事项】 (1)疫苗不可冻结,用前应摇匀。
(2)使用前疫苗温度应达到室温。
(3)使用时应确保接种器具清洁、无菌。
(4)不可静脉注射。
(5)仅用于接种健康鸡。
(6)接种时,应执行常规无菌操作。
(7)用过的疫苗瓶、器具和未用完的疫苗等应进行无害化处理。
(8)如误将疫苗注入人体,特别是高压注射在手指及手腕部位时,可能会产生剧烈的局部炎症反应,应立即采取下列措施:A. 用消毒剂消毒或用肥皂水清洗注射部位 B. 冰敷该部位 C. 紧急就医(同时向医生出示标签、说明书或疫苗等)。对医生的提示:该疫苗为灭活产品,且不会导致任何人畜共患病,对就诊者应采取下列措施:①仔细清洁创面 ②检查破伤风免疫是否在有效保护期内 ③如果是高压注射在手指或手腕部位,在采取进一步医疗措施前,应征询手部外科医生的意见 ④如必要,应采取相应治疗措施,如给予止痛、消炎及抗组胺药等 ⑤每日进行临床观察。
(9)用于肉鸡时,屠宰前42日内禁用。
【规格】 (1)500 羽份/瓶 (2)1000 羽份/瓶
【包装】 10 瓶/盒
【贮藏与有效期】 在2~8℃下避光保存,有效期为24个月。
【《进口兽药登记许可证》证号】
【生产企业】 勃林格殷格翰动物保健有限公司意大利生产厂
仅在兽医指导下使用
(二)禽病毒性关节炎油乳剂灭活疫苗(Olson WVU2937株)内包装标签
禽病毒性关节炎油乳剂灭活疫苗(Olson WVU2937株)
兽用
500(1000)羽份/瓶
《进口兽药注册证书》证号
有效期至:
生产批号:
详见说明书。
【作用与用途】 用于预防鸡病毒性关节炎。
【用法与用量】 皮下或肌肉注射,每只0.5 ml。
【贮藏与有效期】 在2~8℃下避光保存,有效期为24个月。
【生产企业】 勃林格殷格翰动物保健有限公司意大利生产厂
仅在兽医指导下使用
二、托芬那酸注射液说明书和标签
(一)托芬那酸注射液说明书
宠物用
【兽药名称】
通用名称:托芬那酸注射液
商品名称:痛立定(Tolfedine® 4%)
英文名称:Tolfenamic Acid Injectable Solution
汉语拼音:Tuofennasuan Zhusheye
【主要成分】 托芬那酸
【性状】 本品为无色至微黄色的澄明液体,略黏稠。
【药理作用】 药效学 本品为非甾体类抗炎药(NSAID),是邻氨基苯甲酸的衍生物,经人工合成,属于甲芬灭酸类化合物,该药物具有非甾体结构,具有抗炎、镇痛和解热的作用。托芬那酸抗炎作用和其他非甾体药物类似,通过抑制环氧酶,导致主要的炎性介质前列腺素和血栓素减少而起作用。
药动学 犬按4mg/kg体重(以托芬那酸计)肌内和皮下注射给药,两种给药途径的吸收没有差异,2小时后血浆药物峰浓度为4μg/ml(皮下注射)和3μg/ml(肌内注射);猫按4mg/kg体重(以托芬那酸计)皮下注射给药,吸收迅速,1小时后血浆药物峰浓度为3.9μg/ml。血浆蛋白结合率超过99%,在体内分布广泛,在大多数组织中(消化道、肝脏、肺、肾脏)血浆浓度高,但在脑中浓度较低,且托芬那酸分子及其代谢物难以穿过胎盘屏障。在犬和猫体内的消除半衰期分别为4.4~6.6小时和8.3小时。主要以托芬那酸原形及非活性代谢产物(葡萄糖醛酸)通过胆汁排泄。
【适应证】 用于治疗犬的骨骼-关节和肌肉-骨骼系统疾病引起的炎症和疼痛;用于治疗猫发热综合征。
【用法与用量】 以托芬那酸计。每1kg体重4mg,即每10kg体重用1ml,必要时可在48小时后重复给药。犬:皮下或肌内注射;猫:仅皮下注射。
【不良反应】 如果动物在治疗过程中出现厌食、呕吐、腹泻和便血症状时,需及时联系兽医。治疗过程中患病动物罕见发生呕吐和腹泻现象(发生率1/10000~10/10000),可能伴有短暂的多饮和/或多尿现象。通常情况下,停药后这些症状会自行消失。
【注意事项】 1.患有心脏病或肝病动物禁用本品;患有胃肠道溃疡或出血、血恶液质和对托芬那酸过敏的动物禁用本品。
2.勿超剂量使用或延长使用时间。给药后的止痛效果可能会因疼痛严重的程度不同或动物个体差异而不同。
3.勿在24小时内与其他非甾体类抗炎药同时使用,托芬那酸与血浆蛋白结合率高,并可与其它高血浆蛋白结合药物相互竞争;非甾体类抗炎药可引起吞噬抑制作用,因此在治疗细菌感染的并发炎症时,与适当的抗菌药联合用药可增强疗效。
4.用于6周龄以下或年老的动物,可能会有风险,如需使用,可能需要降低使用剂量并辅以临床监测,可在兽医师指导下使用。
5.对体重较轻的动物,建议使用胰岛素注射器,以便给予准确的剂量。
6.怀孕动物慎用。
7.用于猫时仅可皮下注射。
8.全麻动物请谨慎使用或在兽医师监督下使用。
9.在无菌条件下使用本品。
10.避免意外自我注射事故,如本品接触到眼睛和皮肤,迅速用水冲洗干净。
11.使用后瓶体及过期药物应按照当地医用废弃物法规处理。
【休药期】 无需制定。
【规格】 (1)10ml:0.4g (2)30ml:1.2g
【包装】
【贮藏】 遮光,25℃以下保存。
【有效期】 36个月;开启后28日内有效。
【进口兽药注册证号】
【生产企业】 法国威隆制药股份有限公司(Vetoquinol S.A.)
地址:Magny Vernois, 70200 Lure, France
(二)托芬那酸注射液标签
宠物用
【兽药名称】
通用名称:托芬那酸注射液
商品名称:痛立定(Tolfedine® 4%)
英文名称:Tolfenamic Acid Injectable Solution
汉语拼音:Tuofennasuan Zhusheye
【主要成分】 托芬那酸
【性状】 本品为无色至微黄色的澄明液体,略黏稠。
【适应证】 用于治疗犬的骨骼-关节和肌肉-骨骼系统疾病引起的炎症和疼痛;用于治疗猫发热综合征。
【用法与用量】 以托芬那酸计。每1kg体重4mg,即每10kg体重用1ml,必要时可在48小时后重复给药。犬:皮下或肌内注射;猫:仅皮下注射。
【规格】 (1)10ml∶0.4g (2)30ml∶1.2g
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【休药期】 无需制定。
【贮藏】 遮光,25℃以下保存。
【包装】 (1)10ml/瓶×1瓶/盒 (2)30ml/瓶×1瓶/盒
【生产企业】 法国威隆制药股份有限公司(Vetoquinol S.A.)
地址:Magny Vernois, 70200 Lure, France
三、猪伪狂犬病灭活疫苗(Bartha K61株)说明书和内包装标签
(一)猪伪狂犬病灭活疫苗(Bartha K61株)说明书
兽用
【兽药名称】
通用名 猪伪狂犬病灭活疫苗(Bartha K61株)
商品名 无
英文名 Swine Pseudorabies Vaccine,Inactivated(Strain Bartha K61)
汉语拼音 Zhu Weikuangquanbing Miehuoyimiao(Bartha K61 Zhu)
【主要成分与含量】 含猪伪狂犬病病毒gE基因缺失Bartha K61株,灭活前病毒滴度至少为107.5TCID50/头份。
【性状】 略带粉红色的均匀乳剂。
【作用与用途】 用于预防猪伪狂犬病。
【用法与用量】 颈部肌肉深部注射。2月龄以上的猪,每头2ml(含1头份)。
种猪 后备种猪进入猪舍时,进行一次免疫接种,间隔4~5周,进行第二次免疫接种;对于以前没有接种的种猪,也按同样的方法接种两次。怀孕母猪在每次妊娠40~60日时进行接种。种公猪,每隔6个月接种一次。
育肥猪 在2月龄时免疫接种2ml(含1头份)的疫苗,3~4周后进行第二次免疫接种。
【不良反应】 个别猪接种后可能会出现过敏现象,对出现过敏现象的猪应立即使用抗组胺药物进行脱敏治疗。
【注意事项】 (1)使用前应先将疫苗恢复至室温。
(2)疫苗应避光保存,切勿冻结。
(3)使用前应充分摇匀。
(4)用过的疫苗瓶、器具和未用完的疫苗等应进行无害化处理。
【规格】 20头份(40ml)/瓶
【包装】 (1)1瓶/盒 (2)2瓶/盒
【贮藏与有效期】 2~8℃保存,有效期为18个月。
【《进口兽药注册证书》证号】
【生产企业】 西班牙海博莱生物大药厂(LABORATORIOS HIPRA,S.A.)
地址 Avda. La Selva, 135. 17170 Amer (Girona)- Spain
仅在兽医指导下使用
(二)猪伪狂犬病灭活疫苗(Bartha K61株)内包装标签
兽用
猪伪狂犬病灭活疫苗(Bartha K61株)
20头份(40ml)/瓶
《进口兽药注册证书》证号:
批号
有效期至:
【作用与用途】 用于预防猪伪狂犬病。
【用法与用量】 颈部肌肉深部注射。2月龄以上的猪,每头2ml(含1头份)。
【贮藏与有效期】 2~8℃保存,有效期为18个月。
【生产企业】 西班牙海博莱生物大药厂(LABORATORIOS HIPRA,S.A.)
仅在兽医指导下使用
四、右旋糖酐铁注射液说明书和标签
(一)右旋糖酐铁注射液说明书
兽用
【兽药名称】
通用名:右旋糖酐铁注射液
商品名:加强铁补乐(Dexprol 200)
英文名:Iron Dextran Injection
汉语拼音:Youxuantanggan Tie Zhusheye
【主要成分】 右旋糖酐与氢氧化铁的络合物。
【性状】 本品为深褐色的胶体溶液。
【药理作用】 抗贫血药。铁是血红蛋白及肌红蛋白的重要组成成分,血红蛋白是红细胞的主要运输氧的成分,肌红蛋白是肌肉细胞等储存氧的部位,在肌肉运动时进行氧的交换。体内参与三羧酸循环有关的大多数酶需要铁的参与,有些反应甚至有铁这一特殊成分存在时,才能发挥生理生化反应和作用。铁缺乏不仅能引起贫血,还可能影响其它生理功能。右旋糖酐铁肌注后主要通过淋巴系统缓慢吸收。注射后3日内约有60%的铁被吸收,1~3周后吸收达到90%,余下的药物可能在数月内被缓慢吸收,肝、脾和骨髓网状内皮细胞能逐步从血浆中清除吸收的药物。从右旋糖酐中解离的铁立即与蛋白分子结合形成含铁血黄素、铁蛋白或转铁蛋白,而右旋糖酐则被代谢或排泄。
【适应证】 主要用于仔猪缺铁性贫血的预防和治疗。
【用法与用量】 以本品计。肌内注射:1~3日龄仔猪,每头1ml。
【不良反应】 1. 在注射部位罕见地观察到变色情况。
2. 仔猪在注射铁基制剂后偶尔会死亡,这些死亡与遗传因素或维生素E或硒缺乏有关。
【注意事项】 1. 谨慎注射以减少休克风险,部分动物(通常有强健体格)可能对注射极为敏感。
2. 在注射过程中,严格遵守有关无菌条件的说明。
3. 屠宰前一个月停止注射,以免注射部位变色。
4. 硒/维生素E缺乏母猪的仔猪更容易发生铁中毒。
5. 需防冻,久置可发生沉淀。
【休药期】 不需要制定。
【规格】 按Fe计算 100ml∶20g
【包装】 100ml/瓶
【贮藏】 遮光,密闭,在阴凉干燥处保存。
【有效期】 24个月。
【进口兽药注册证号】
【生产企业】 法国维克有限公司(Virbac)
地址:1ere, Avenue 2065 M L I D, 06510 Carros, France
(二)右旋糖酐铁注射液标签
兽用
【兽药名称】
通用名:右旋糖酐铁注射液
商品名:加强铁补乐(Dexprol 200)
英文名:Iron Dextran Injection
汉语拼音:Youxuantanggan Tie Zhusheye
【主要成分】 右旋糖酐与氢氧化铁的络合物
【性状】 本品为深褐色的胶体溶液。
【适应证】 主要用于仔猪缺铁性贫血的预防和治疗。
【用法与用量】 以本品计。肌内注射:1~3日龄仔猪,每头1ml。
【规格】 按Fe计算 100ml∶20g
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】 至
【休药期】 不需要制定。
【贮藏】 遮光,密闭,在阴凉干燥处保存。
【包装】 100ml/瓶
【生产企业】 法国维克有限公司(Virbac)
地址:1ere, Avenue 2065 M L I D, 06510 Carros, France
五、马波沙星片说明书和标签
(一)马波沙星片说明书
宠物用
【兽药名称】
通用名称:马波沙星片
商品名称:麻佛美味片®(Marbocyl®P)
英文名称:Marbofloxacin Tablets
汉语拼音:Maboshaxing Pian
【主要成分】 马波沙星
【性状】 本品为淡黄色至淡褐色,略带有斑点、圆形或椭圆形刻痕片。
【药理作用】 药效学 氟喹诺酮类抗菌药。马波沙星通过抑制DNA回旋酶的活性,从而抑制细菌DNA的复制和转录。马波沙星抗菌谱广,对革兰氏阳性菌(葡萄球菌、链球菌)和革兰氏阴性菌(大肠埃希氏菌、鼠伤寒沙门氏菌、弗氏柠檬酸杆菌、阴沟肠杆菌、粘质沙雷氏菌、摩氏摩根氏菌、变形杆菌属、克雷伯氏菌属、志贺氏菌属、巴氏杆菌属、嗜血杆菌属、莫拉菌属、假单胞菌属、犬布鲁氏菌等)以及支原体有效。
药动学 犬和猫按2mg/kg体重(以马波沙星计)内服给药,吸收迅速,2小时内血药浓度达峰值,约为1.5μg/ml。生物利用度接近100%。血浆蛋白结合率较低(不超过10%),在体内分布广泛,在大多数组织中(肝脏、肾脏、皮肤、肺、膀胱、消化道)的浓度高于血浆浓度。在体内消除缓慢,在犬和猫体内的消除半衰期分别为14小时和10小时。主要以原形通过尿(占2/3)和粪便(占1/3)排泄。
药物相互作用 氟喹诺酮类药物会与内服给药的阳离子(铝、钙、镁、铁)相互作用。在这种情况下会降低氟喹诺酮类药物的生物利用度。
【适应证】 用于治疗由敏感菌引起的犬皮肤和软组织感染(如皮肤褶皱脓皮病、脓包性皮炎、毛囊炎、疖病和蜂窝组织炎等),治疗伴发或未伴发前列腺炎的尿路感染;用于治疗猫皮肤和软组织感染(如创伤、脓肿和蜂窝组织炎等)。
【用法与用量】 以马波沙星计。内服:每1kg体重2mg,每日1次。
小型犬,每2.5kg体重给予5mg规格一片;中型犬,每10kg体重给予20mg规格一片;大型犬,每40kg体重给予80mg规格一片;用于治疗皮肤和软组织感染,至少持续用药5日,根据病程,给药期最长可延至40日;用于治疗尿路感染,给药期至少为10日,根据病程,给药期最长可延至28日。
猫,用于治疗皮肤和软组织感染,给药期为3~5日。
【不良反应】
1. 按推荐治疗剂量使用时,在犬和猫中未发现严重不良反应,而且在临床研究中也未出现关节损伤。
2. 偶尔会出现轻微的不良反应,如呕吐、粪便变软、饮水变化或暂时的活动性增加,这些症状在治疗结束后会自行消失,无需刻意停止治疗。
3. 氟喹诺酮类药物可能会对幼犬的关节软骨造成损害,幼犬用药时应准确计算剂量并小心看护。
4. 氟喹诺酮类药物具有潜在的神经副作用,对患有癫痫的犬和猫慎用。
【禁忌症】
1. 禁用于小于12月龄的犬或小于18月龄的大型犬(如大丹犬、伯瑞犬、伯恩布维耶犬和獒犬等),不推荐用于小于16周龄的猫。
2. 不适用于由厌氧菌、酵母菌或真菌引起的感染。
【注意事项】
1. 请在兽医指导下使用。
2. 为防止细菌对氟喹诺酮类药物产生耐药或交叉耐药,必要时,进行药敏试验后选择本品。
3. 尿液的低pH值会对马波沙星的活性有抑制作用。
4. 过量给药会引起急性神经障碍,应进行对症治疗。
5. 在妊娠大鼠和兔子的试验中,未发现马波沙星对妊娠动物存在副作用,但妊娠犬和猫尚无试验研究数据,因此,妊娠期的犬猫慎用本品。
6. 对氟喹诺酮类药物过敏的人群应避免接触本品,如发生误服,请立即就医并出示产品标签和/或说明书。
7. 取用或分离药片时请戴手套,使用后洗手。
8. 请置于儿童不可接触处。
【规格】 (1)5mg (2)20mg (3)80mg
【包装】
【贮藏】 遮光,25℃以下保存。
【有效期】 36个月。
【进口兽药注册证号】
【生产企业】 法国威隆制药股份有限公司(Vetoquinol S.A.)
地址:Magny Vernois, 70200 Lure, France
(二)马波沙星片标签
宠物用
【兽药名称】
通用名称:马波沙星片
商品名称:麻佛美味片®(Marbocyl®P)
英文名称:Marbofloxacin Tablets
汉语拼音:Maboshaxing Pian
【主要成分】 马波沙星
【性状】 本品为淡黄色至淡褐色,略带有斑点、圆形或椭圆形刻痕片。
【适应证】 用于治疗由敏感菌引起的犬皮肤和软组织感染(如皮肤褶皱脓皮病、脓包性皮炎、毛囊炎、疖病和蜂窝组织炎等),治疗伴发或未伴发前列腺炎的尿路感染;用于治疗猫皮肤和软组织感染(如创伤、脓肿和蜂窝组织炎等)。
【用法与用量】 以马波沙星计。内服:每1kg体重2mg,每日1次。
小型犬,每2.5kg体重给予5mg规格一片;中型犬,每10kg体重给予20mg规格一片;大型犬,每40kg体重给予80mg规格一片;用于治疗皮肤和软组织感染,至少持续用药5日,根据病程,给药期最长可延至40日;用于治疗尿路感染,给药期至少为10日,根据病程,给药期最长可延至28日。
猫,用于治疗皮肤和软组织感染,给药期为3~5日。
【规格】 (1)5mg (2)20mg (3)80mg
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【贮藏】 遮光,25℃以下保存。
【包装】
【生产企业】 法国威隆制药股份有限公司(Vetoquinol S.A.)
地址:Magny Vernois, 70200 Lure, France
六、恩诺沙星注射液说明书和标签
(一)恩诺沙星注射液说明书
兽用处方药
【兽药名称】
通用名称:恩诺沙星注射液
商品名称:拜有利®(Baytril®)
英文名称:Enrofloxacin Injection
汉语拼音:Ennuoshaxing Zhusheye
【主要成分】 恩诺沙星
【性状】 本品为淡黄色澄明液体。
【药理作用】 氟喹诺酮类抗菌药。本品是动物专用的广谱杀菌药。对大肠埃希菌、沙门氏菌、克雷伯氏杆菌、布鲁氏菌、巴氏杆菌、胸膜肺炎放线杆菌、丹毒杆菌、变形杆菌、黏质沙雷氏菌、化脓性棒状杆菌、败血波特氏菌、金黄色葡萄球菌、支原体、衣原体等均有良好作用;对绿脓杆菌、链球菌作用较弱,对厌氧菌作用微弱。恩诺沙星作用于细菌细胞的DNA旋转酶,干扰细菌DNA的复制、转录和修复重组,使细菌不能正常生长繁殖而死亡。
【适应证】 用于治疗猪的细菌及支原体感染。
【用法与用量】 以恩诺沙星计。肌内注射:一次量,每1kg体重,猪2.5mg,一日1次,连用3~5日。
【不良反应】
1. 极少数情况下可能出现轻度、短暂的消化道功能紊乱(如腹泻)。
2. 猪肌内注射时,注射部位可能出现炎症反应并可能持续到注射后的28日。
【注意事项】
1. 患有癫痫或与中枢神经系统有关的癫痫及对氟喹诺酮类药物过敏的动物禁用。
2. 对其他抗生素类药物治疗效果欠佳或预期疗效不佳的临床疾病,应慎用。
3. 肾功能受损动物慎用。
4. 猪的每个注射部位不得超过2.5ml。
5. 超过推荐剂量使用时,有可能会发生消化道不良反应(如:呕吐,腹泻)和神经系统紊乱;猪超过5倍推荐剂量给药时无不良反应报告。
6. 本品在怀孕患畜中的安全评估尚未建立。对于期间使用的风险评估请遵医嘱。
7. 本品与大环内酯类、四环素合用可能会产生拮抗效应;与茶碱合用,可能导致茶碱的消除延迟。
8. 现有欧洲常见病原菌的耐药性监控数据表明:猪呼吸道感染分离的胸膜肺炎放线杆菌、败血波特氏菌、副猪嗜血杆菌、肺炎支原体、巴氏杆菌,泌尿道感染和产后泌乳障碍综合征(PPDS)分离的大肠埃希菌以及消化道感染分离的沙门氏菌对恩诺沙星敏感性高,耐药性低;胃肠道感染分离的大肠埃希菌对恩诺沙星耐药性为无至中度。建议在条件允许的情况下根据药敏试验使用氟喹诺酮类药物,未遵从产品说明书用法用量可能会增加耐药性;由于潜在的交叉耐药性,可能会降低对所有氟喹喏酮类治疗的有效性。
9. 勿冷藏或冷冻。
10. 避免儿童接触本品。
11. 对氟喹诺酮类过敏的人员勿接触本品;使用药物时,不得进食、喝水或抽烟;用后洗手。避免皮肤和眼睛接触。如不慎溅到皮肤和眼睛,立即用水冲洗。
12. 本品无特效解毒药,若中毒,请对症治疗。
13. 未使用的兽药产品或来自该类兽药产品的废弃物,应按照当地法规要求处置。
【休药期】 猪10日。
【规格】 100ml∶5g
【包装】 100ml/瓶
【贮藏】 密闭,在干燥处保存。
【有效期】 48个月,开瓶后28日。
【进口兽药注册证号】
【生产企业】 KVP Kiel有限责任公司(KVP Pharma + Veterinär Produkte GmbH)
地址:Projensdorfer Straβe 324, D-24106 Kiel, Germany
兽用处方药
【兽药名称】
通用名称:恩诺沙星注射液
商品名称:拜有利®(Baytril®)
英文名称:Enrofloxacin Injection
汉语拼音:Ennuoshaxing Zhusheye
【主要成分】 恩诺沙星
【性状】 本品为淡黄色澄明液体。
【药理作用】 氟喹诺酮类抗菌药。本品是动物专用的广谱杀菌药。对大肠埃希菌、沙门氏菌、克雷伯氏杆菌、布鲁氏菌、巴氏杆菌、胸膜肺炎放线杆菌、丹毒杆菌、变形杆菌、黏质沙雷氏菌、化脓性棒状杆菌、败血波特氏菌、金黄色葡萄球菌、支原体、衣原体等均有良好作用;对绿脓杆菌、链球菌作用较弱,对厌氧菌作用微弱。恩诺沙星作用于细菌细胞的DNA旋转酶,干扰细菌DNA的复制、转录和修复重组,使细菌不能正常生长繁殖而死亡。
【适应证】 用于治疗猪和牛的细菌及支原体感染。
【用法与用量】 以恩诺沙星计。肌内注射:一次量,每1kg体重,猪2.5mg,一日1次,连用3~5日。皮下、静脉注射:一次量,每1kg体重,牛2.5~5mg,一日1次,连用3~5日。
【不良反应】
1. 极少数情况下可能出现轻度、短暂的消化道功能紊乱(如腹泻)。
2. 猪肌内注射时,注射部位可能出现炎症反应并可能持续到注射后的28日。
3. 牛静脉注射时,极少数情况下因循环系统紊乱而引起休克。
【注意事项】
1. 患有癫痫或与中枢神经系统有关的癫痫及对氟喹诺酮类药物过敏的动物禁用。
2. 对其他抗生素类药物治疗效果欠佳或预期疗效不佳的临床疾病,应慎用。
3. 肾功能受损动物慎用。
4. 猪的每个注射部位不得超过2.5ml;牛皮下注射每个注射部位不得超过10ml,犊牛不得超过5ml。
5. 超过推荐剂量使用时,有可能会发生消化道不良反应(如:呕吐,腹泻)和神经系统紊乱;猪超过5倍推荐剂量给药时无不良反应报告。
6. 本品在怀孕患畜中的安全评估尚未建立。对于期间使用的风险评估请遵医嘱。
7. 本品与大环内酯类、四环素合用可能会产生拮抗效应;与茶碱合用,可能导致茶碱的消除延迟。
8. 现有欧洲常见病原菌的耐药性监控数据表明:猪呼吸道感染分离的胸膜肺炎放线杆菌、败血波特氏菌、副猪嗜血杆菌、肺炎支原体、巴氏杆菌,泌尿道感染和产后泌乳障碍综合征(PPDS)分离的大肠埃希菌以及消化道感染分离的沙门氏菌对恩诺沙星敏感性高,耐药性低;胃肠道感染分离的大肠埃希菌对恩诺沙星耐药性为无至中度。牛呼吸道感染分离的睡眠嗜血杆菌、溶血性曼氏杆菌、多杀性巴氏杆菌、牛支原体,乳房炎分离的大肠埃希菌、克雷伯氏杆菌以及消化道感染分离的沙门氏菌对恩诺沙星敏感性高,耐药性低;消化道感染分离的大肠埃希菌对恩诺沙星耐药率变化大,未见随时间变化的相关性。建议在条件允许的情况下根据药敏试验使用氟喹诺酮类药物,未遵从产品说明书用法用量可能会增加耐药性;由于潜在的交叉耐药性,可能会降低对所有氟喹喏酮类治疗的有效性。
9. 勿冷藏或冷冻。
10. 避免儿童接触本品。
11. 对氟喹诺酮类过敏的人员勿接触本品;使用药物时,不得进食、喝水或抽烟;用后洗手。避免皮肤和眼睛接触。如不慎溅到皮肤和眼睛,立即用水冲洗。
12. 本品无特效解毒药,若中毒,请对症治疗。
13. 未使用的兽药产品或来自该类兽药产品的废弃物,应按照当地法规要求处置。
【休药期】 猪10日。牛:静脉注射7日,皮下注射14日;弃奶期:静脉注射3日,皮下注射5日。
【规格】 100ml:10g
【包装】 100ml/瓶
【贮藏】 密闭,在干燥处保存。
【有效期】 48个月,开瓶后28日。
【进口兽药注册证号】
【生产企业】 KVP Kiel有限责任公司(KVP Pharma + Veterinär Produkte GmbH)
地址:Projensdorfer Straβe 324, D-24106 Kiel, Germany
(二)恩诺沙星注射液标签
兽用处方药
【兽药名称】
通用名称:恩诺沙星注射液
商品名称:拜有利®(Baytril®)
英文名称:Enrofloxacin Injection
汉语拼音:Ennuoshaxing Zhusheye
【主要成分】 恩诺沙星
【性状】 本品为淡黄色澄明液体。
【适应证】 用于治疗猪的细菌及支原体感染。
【用法与用量】 以恩诺沙星计。肌内注射:一次量,每1kg体重,猪2.5mg,一日1次,连用3~5日。
【规格】 100ml∶5g
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【休药期】 猪10日。
【贮藏】 密闭,在干燥处保存。
【包装】 100ml/瓶
【生产企业】 KVP Kiel有限责任公司(KVP Pharma + Veterinär Produkte GmbH)
地址:Projensdorfer Straβe 324, D-24106 Kiel, Germany
兽用处方药
【兽药名称】
通用名称:恩诺沙星注射液
商品名称:拜有利®(Baytril®)
英文名称:Enrofloxacin Injection
汉语拼音:Ennuoshaxing Zhusheye
【主要成分】 恩诺沙星
【性状】 本品为淡黄色澄明液体。
【适应证】 用于治疗猪和牛的细菌及支原体感染。
【用法与用量】 以恩诺沙星计。肌内注射:一次量,每1kg体重,猪2.5mg,一日1次,连用3~5日。皮下、静脉注射:一次量,每1kg体重,牛2.5~5mg,一日1次,连用3~5日。
【规格】 100ml:10g
【进口兽药注册证号】
【生产日期】
【生产批号】
【有效期】至
【休药期】 猪10日。牛:静脉注射7日,皮下注射14日;弃奶期:静脉注射3日,皮下注射5日。
【贮藏】 密闭,在干燥处保存。
【包装】 100ml/瓶
【生产企业】 KVP Kiel有限责任公司(KVP Pharma + Veterinär Produkte GmbH)
地址:Projensdorfer Straβe 324, D-24106 Kiel, Germany
附件4
恩诺沙星残留检测方法标准(试行)牛可食性组织中恩诺沙星残留量检测
液相色谱-串联质谱法(试行)
本标准规定了牛可食性组织中恩诺沙星和环丙沙星残留量的液相色谱-串联质谱测定方法。
本标准适用于牛的肌肉、肝脏、肾脏、脂肪中恩诺沙星和环丙沙星残留量的检测。
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 6682 分析实验室用水规格和试验方法
试料中残留的恩诺沙星、环丙沙星经提取液提取,离心后取上清液,以正己烷净化,弃正己烷层,下层溶液氮气流吹干后复溶,离心,上清液以液相色谱-串联质谱仪测定恩诺沙星、环丙沙星残留量,内标法定量。
以下所用的试剂,除特别注明者外均为分析纯试剂;水为符合GB/T 6682规定的一级水。
4.1 对照品:恩诺沙星,含量≥95%;盐酸环丙沙星,含量≥95%;盐酸恩诺沙星-d5,含量均≥95%;盐酸环丙沙星-d8,含量≥90%。
4.2 乙腈:分析纯。
4.3 乙腈:色谱纯。
4.4 甲醇:分析纯。
4.5 甲醇:色谱纯。
4.6 甲酸:分析纯。
4.7 甲酸:色谱纯。
4.8 正己烷。
4.9 1%甲酸乙腈溶液:准确量取甲酸1mL,置100mL 容量瓶中,用乙腈稀释至刻度,充分混匀。
4.10 1%甲酸乙腈溶液-甲醇(95:5, V/V)溶液:准确量取甲醇5mL,置100mL容量瓶中,用1%甲酸乙腈溶液稀释至刻度,混匀。
4.11 0.1%甲酸溶液:准确量取甲酸(色谱纯)1.00mL,置1L容量瓶中,用超纯水稀释至刻度,混匀。
4.12 0.1%甲酸溶液-乙腈(95:5, V/V):准确量取乙腈(色谱纯)5mL,置100mL 容量瓶中,加入0.1%甲酸溶液稀释至刻度,混匀。
4.13 乙腈饱和的正己烷:取一定量的正己烷加入适量乙腈,直至充分混匀静置后有分层为止。
4.14 标准储备液:根据各对照品的含量,精密称取各对照品适量,恩诺沙星、环丙沙星配制成浓度为200µg/mL的储备液,恩诺沙星-d5、环丙沙星-d8配制成浓度为100µg/mL的储备液。将精密称取的单个对照品分别置于10mL 棕色容量瓶中,加入甲醇(色谱纯)约5mL,涡旋、超声使溶解,再用甲醇(色谱纯)稀释并定容至10mL。-20℃保存,有效期3个月。使用时将标准储备液按需要用甲醇(色谱纯)逐级稀释为标准工作溶液(10µg/mL、1µg/mL或100ng/mL),现配现用。
5.1液相色谱-串联质谱仪:配电喷雾离子源。
5.2天平:感量 0.01g。
5.3分析天平:感量 0.00001g。
5.4移液器:容量20~200µL,100~1000µL。
5.5高速组织捣碎机。
5.6高速冷冻离心机。
5.7涡旋混合器。
5.8摇床。
5.9超声波清洗器。
5.10氮气吹干仪。
5.11有机滤膜:0.22µm。
取适量新鲜或解冻的样品去筋,经高速组织捣碎机均匀捣碎,作为试料。
试料的制备包括:
—— 取匀质的供试样品,作为供试试料。
—— 取匀质的空白样品,作为空白试料。
—— 取匀质的空白样品,添加适宜浓度的标准工作液,作为空白添加试料。
-20±5℃贮存备用。
准确称取试样2±0.02g,加入相应体积的混合内标工作液,使内标(恩诺沙星-d5、环丙沙星-d8)的添加浓度均为50ng/g,涡旋混匀,避光静置30min。加入1%甲酸乙腈-甲醇(95:5, V/V)溶液5mL涡旋混匀,放入超声波清洗器中水浴超声15min,300mot/min,水平振荡20min,于4℃以8000r/min离心10min。将上清液转移至15mL聚丙烯离心管中,样品残渣用1%甲酸乙腈-甲醇(95:5, V/V)溶液4mL按以上方法重复提取一次,合并两次上清液于15mL离心管中。再用 1%甲酸乙腈溶液-甲醇(95:5, V/V)溶液将其定容至10mL,涡旋约30s,300mot/min,水平振荡10min使充分混合均匀,于4℃以8000r/min离心10min。将上清液移至另一15mL离心管中。
准确移取最终得到的上清液2mL于玻璃试管中,加入乙腈饱和的正己烷3mL涡旋约1 min,静置至分层,弃去上层的正己烷层,再加入乙腈饱和的正己烷3mL重复除脂肪一次。将剩余溶液置于45℃恒温水浴锅中,氮气吹干。向吹干后的试管中加入0.1%甲酸溶液-乙腈(95:5, V/V)溶液1mL,涡旋超声5min,再涡旋充分溶解残渣。然后将其移至2mL EP管中,于4℃以15000r/min离心15min。上清液过0.22µm有机滤膜,供液相色谱-串联质谱仪检测。
用各空白样品按照前处理方法处理后得到的空白基质液将恩诺沙星、环丙沙星标准溶液均稀释成浓度为1、2、5、10、20、40、80、160ng/mL的系列基质匹配标准工作液,内标(恩诺沙星-d5、环丙沙星-d8)的浓度均为20ng/ml。供液相色谱-串联质谱法测定。以测得的恩诺沙星、环丙沙星及内标的特征离子质量色谱峰面积之比为纵坐标,对应的浓度为横坐标,绘制标准曲线,求回归方程和相关系数。
色谱柱:Luna C18(2) (150mm×2.0mm i.d., 5µm)或其他等效色谱柱。
流速:250µL/min。
柱温:35℃。
进样量:5µL。
流动相:流动相A(0.1%甲酸溶液)和流动相B(乙腈),采用梯度洗脱,线性梯度洗脱程序见表1。
表1 梯度洗脱程序
|
时间(min) |
A% |
B% |
|
0 |
95 |
5 |
|
3 |
95 |
5 |
|
8 |
75 |
25 |
|
12 |
30 |
70 |
|
14 |
95 |
5 |
|
16 |
95 |
5 |
离子源:电喷雾离子源。
扫描方式:正离子扫描。
检测方式:多反应监测。
电离电压:3500V。
源温:300℃。
雾化温度:250℃。
锥孔气流速:360L/h。
雾化气流速:660L/h。
恩诺沙星、环丙沙星和内标的定性、定量离子对及锥孔电压、碰撞能量见表2。
表2 恩诺沙星、环丙沙星和内标的定性、定量离子对及锥孔电压、碰撞能量
|
药物 |
定性离子对(m/z) |
锥孔电压(V) |
碰撞能量(eV) |
|
恩诺沙星 |
360.2>316.2a |
130 |
12 |
|
360.2>342.2 |
16 |
||
|
恩诺沙星-d5 |
365.2>288.1 |
130 |
40 |
|
环丙沙星 |
332.2>288.3a |
130 |
12 |
|
332.2>314.2 |
12 |
||
|
环丙沙星-d8 |
340.2>322.1 |
130 |
20 |
(a定量离子)
7.3.3样品测定
取试样溶液和相应的基质匹配标准溶液,作单点或多点校准,按内标法以峰面积比计算。对照溶液及试样溶液中恩诺沙星、环丙沙星和内标的响应值均应在仪器检测的线性范围之内。试样溶液中的离子相对丰度与标准溶液的离子相对丰度比符合表3的要求。标准溶液和空白组织及空白组织添加试样溶液的各特征离子的质量色谱图见附录A。
表3 试样溶液中离子相对丰度的允许偏差范围
|
相对离子丰度 |
>50% |
>20%至50% |
>10%至20% |
≤10% |
|
允许的相对偏差 |
±20% |
±25% |
±30% |
±50% |
取空白试料,采用完全相同的测定步骤进行平行操作。
单点校准: 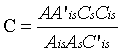 ………………………………(1)
………………………………(1)
或标准曲线校准:由![]() 求得a和b,则
求得a和b,则
![]() ………………………………(2)
………………………………(2)
试料中药物残留量按式(3)计算:
![]() ………………………………(3)
………………………………(3)
式中:
C ——试样溶液中药物的浓度,ng/mL;
A ——试样溶液中药物的峰面积;
A’is ——对照溶液中药物内标的峰面积;
Cs ——对照溶液中药物的浓度,ng/mL;
Cis ——试样溶液中药物内标的浓度,ng/mL;
Ais ——试样溶液中药物内标的峰面积;
As ——对照溶液中药物的峰面积;
C’is ——对照溶液中药物内标的浓度,ng/mL;
X ——供试试料中药物的残留量,µg/kg;
V ——溶解残余物的体积,mL;
m ——供试试料质量,g。
注:计算结果需扣除空白值,测定结果用平行测定的算术平均值表示,保留三位有效数字。
本方法在牛肌肉、肝脏、肾脏、脂肪中的定量限为10µg/kg。
本方法在牛肌肉组织中恩诺沙星和环丙沙星在10~200µg/kg添加浓度范围内,牛肝脏组织中恩诺沙星和环丙沙星在10~600µg/kg添加浓度范围内,牛肾脏组织中恩诺沙星和环丙沙星在10~400µg/kg添加浓度范围内和牛脂肪组织中恩诺沙星和环丙沙星在10~200µg/kg添加浓度范围内时,回收率范围均为60%~110%。
本方法在批内相对标准偏差小于15%,本方法在批间相对标准偏差小于20%。
附录A
(资料性附录)
特征离子质量色谱图
|
|
|
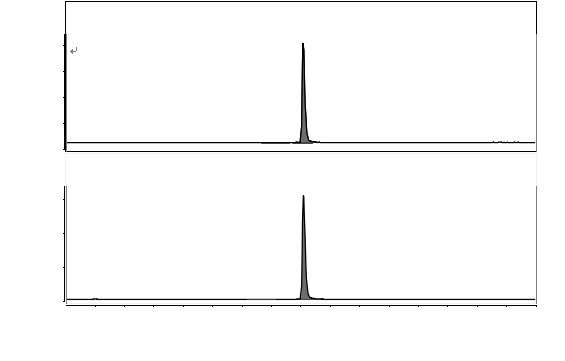
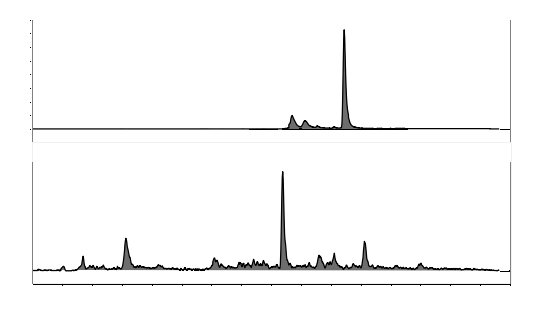
图A.1 恩诺沙星及恩诺沙星-d5对照溶液特征离子质量色谱图 |
|
|
|
图A.2 环丙沙星及环丙沙星-d8对照溶液特征离子质量色谱图 |
|
|
|
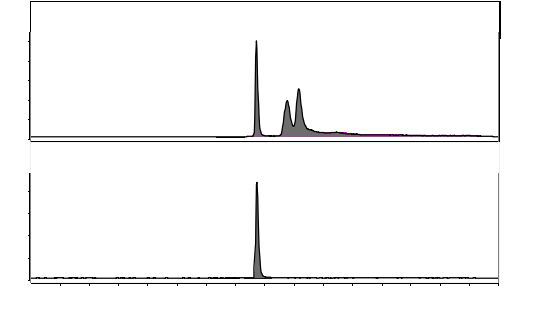
|
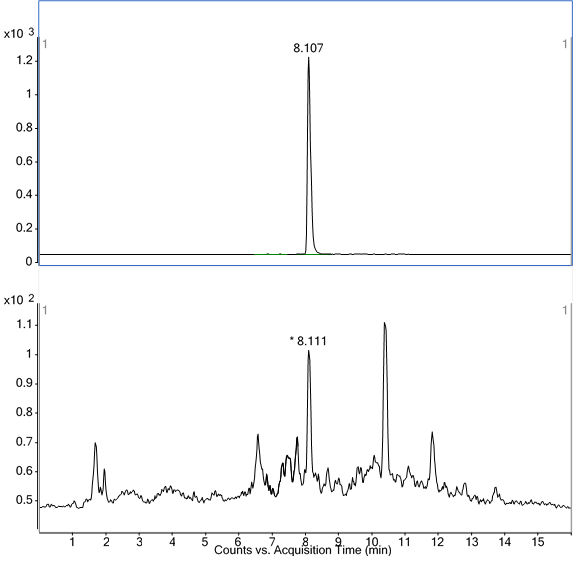
图A.3 空白牛肝脏组织溶液中特征离子质量色谱图-恩诺沙星 |
|
|
|
|
|
图A.4 空白牛肝脏组织溶液中特征离子质量色谱图-环丙沙星 |
|
|
|
|
|
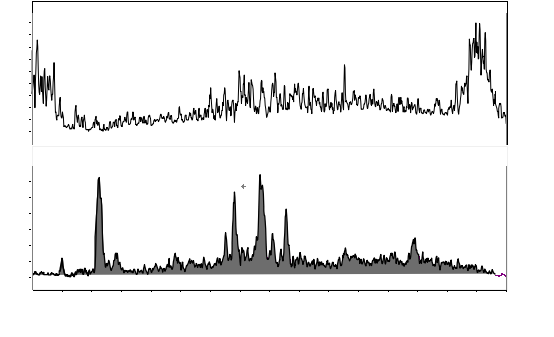
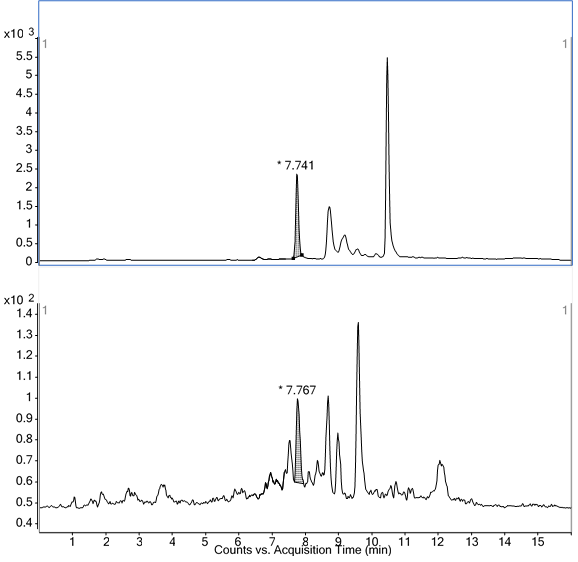
图A.5 牛肝脏基质添加恩诺沙星及内标特征离子质量色谱图(上图恩诺沙星-d5:20μg/L;下图恩诺沙星:1μg/L) |
|
|
|
|
|
图A.6 牛肝脏基质添加环丙沙星及内标特征离子质量色谱图(上图环丙沙星-d8:20μg/L;下图环丙沙星:1μg/L) |
|
相关新闻
- 中华人民共和国农业农村部公告第469号 2021-12-07
- 中华人民共和国农业农村部公告第474号 2021-12-07
- 中华人民共和国农业农村部公告第355号 2021-01-29
- 中华人民共和国农业农村部公告第344号 2020-12-20
- 中华人民共和国农业农村部公报第332号 2020-11-30



 提示信息
提示信息