中华人民共和国农业农村部公告第344号
根据《兽药管理条例》和《兽药注册办法》规定,经审查,批准硕腾公司美国林肯生产厂生产的沙罗拉纳咀嚼片在我国注册,核发《进口兽药注册证书》,并发布产品质量标准、说明书、标签,自发布之日起执行。
批准英特威美国分公司等4家公司生产的肉鸡球虫活疫苗等4种兽药在我国再注册,核发《进口兽药注册证书》,并发布修订后的产品质量标准、说明书、标签,自发布之日起执行。此前发布的该产品兽药质量标准、说明书和标签同时废止。
批准荷兰优诺威动物保健公司生产的土霉素注射液在我国变更注册,并发布变更后的产品质量标准、说明书和标签,自发布之日起执行。此前发布的该产品兽药质量标准、说明书和标签同时废止。
批准梅里亚有限公司法国吐鲁兹生产厂等3家公司生产的阿福拉纳咀嚼片等3种兽药产品在我国变更注册。
特此公告。
附件:1.进口兽药注册目录
2.质量标准
3.说明书和标签
农业农村部
2020年10月14日
附件1
进口兽药注册目录
|
兽药名称 |
生产厂名称 |
国 别 |
进口兽药 注册 证书号 |
有效期限 |
备注 |
|
沙罗拉纳咀嚼片 (5mg) Sarolaner Chewable Tablets (5mg) |
硕腾公司美国林肯生产厂 Zoetis Inc. |
美国
|
(2020) 外兽药证字 44号 |
2020.10.14 — 2025.10.13
|
注册
|
|
沙罗拉纳咀嚼片 (10mg) Sarolaner Chewable Tablets (10mg) |
(2020) 外兽药证字 45号 |
||||
|
沙罗拉纳咀嚼片 (20mg) Sarolaner Chewable Tablets (20mg) |
(2020) 外兽药证字 46号 |
||||
|
沙罗拉纳咀嚼片 (40mg) Sarolaner Chewable Tablets (40mg) |
(2020) 外兽药证字 47号 |
||||
|
沙罗拉纳咀嚼片 (80mg) Sarolaner Chewable Tablets (80mg) |
(2020) 外兽药证字 48号 |
||||
|
沙罗拉纳咀嚼片 (120mg) Sarolaner Chewable Tablets (120mg) |
(2020) 外兽药证字 49号 |
||||
|
肉鸡球虫活疫苗 Coccidiosis Vaccine , Live Oocysts, Chicken Isolates |
英特威美国分公司 Intervet Inc. |
美国 |
(2020) 外兽药证字 50号 |
2020.10.14 — 2025.10.13 |
再注册 |
|
地克珠利混悬液 Diclazuril Suspension |
Lusomedicamenta药业技术有限公司 Lusomedicamenta-Technical Pharmaceutical Society., A.S. |
葡萄牙 |
(2020) 外兽药证字 51号 |
2020.10.14 — 2025.10.13 |
再注册 |
|
鸡减蛋综合征灭活疫苗(127株) Egg Drop Syndrome Vaccine,Inactivated(Strain 127) |
以色列雅贝克生物实验有限公司 ABIC Biological Laboratories Ltd. |
以色列 |
(2020) 外兽药证字 52号 |
2020.10.14 — 2025.10.13 |
再注册 |
|
复方戊二醛溶液 Compound Glutaral Solution |
英国考文垂化学药品有限公司 Coventry Chemicals Limited,United Kingdom |
英国 |
(2020) 外兽药证字 53号 |
2020.10.14 — 2025.10.13 |
再注册 |
|
土霉素注射液 Oxytetracycline Injection |
荷兰优诺威动物保健公司 Eurovet Animal Health BV |
荷兰 |
(2018) 外兽药证字 43号 |
2018.10.18 — 2023.10.17 |
变更注册:变更有效期、修改质量标准 |
|
阿福拉纳咀嚼片 Afoxolaner Chewable Tablets |
梅里亚有限公司法国吐鲁兹生产厂 MERIAL Toulouse |
法国 |
(2017) 外兽药证字 34号 |
2017.06.22 —2022.06.21 |
变更注册:有效期由24个月延长至36个月 |
|
氨基丁三醇前列腺素F2α注射液 Prostaglandin F2α Tromethamine Injection |
法国诗华动物保健公司 CEVA SANTE ANIMALE S.A |
法国 |
(2019) 外兽药证字 99号 |
2019.12.30 —2024.12.29 |
变更注册:有效期由24个月变更为36个月 |
|
(2019) 外兽药证字 100号 |
|||||
|
(2019) 外兽药证字 101号 |
|||||
|
硫酸安普霉素预混剂 Apramycin Sulfate Premix |
美国礼蓝动物保健有限公司英国生产厂 Elanco UK AH Limited |
英国 |
(2016) 外兽药证字 07号 |
2016.03.07 —2021.03.06 |
变更注册:企业名称变更为美国礼蓝动物保健有限公司,Elanco Animal Health Incorporated,生产厂名称变更为美国礼蓝动物保健有限公司英国生产厂Elanco UK AH Limited |
附件2(略)
附件3
沙罗拉纳咀嚼片等6种兽药产品说明书和标签
一、沙罗拉纳咀嚼片说明书和标签
(一)沙罗拉纳咀嚼片说明书
宠物用
[兽药名称]
通用名称:沙罗拉纳咀嚼片
商品名称:欣宠克R(SimparicaR)
英文名称:Sarolaner Chewable Tablets
汉语拼音:Shaluolana Jujuepian
[主要成分]沙罗拉纳
[性状]本品为带斑点的棕色方形片。
[药理作用]沙罗拉纳是异噁唑啉类抗寄生虫药,作用于神经肌肉接头,通过抑制γ一氨基丁酸受体和谷氨酸受体功能,导致螨或昆虫神经肌肉活动失控,进而死亡。
沙罗拉纳内服吸收迅速。禁食犬按2mg/kg剂量一次口服沙罗拉纳咀嚼片后,血浆峰浓度(Cmax)为1100ng/mL,达峰时间(Tmax)为3小时。在禁食犬和进食犬中的口服生物利用度分别为86%和107%,消除半衰期(t1/2)分别为10日和12日。沙罗拉纳呈全身性分布,血浆蛋白结合率高(不低于99.9%),在犬体内代谢极低,主要以原形经胆汁和粪便排泄。
[适应证]用于预防和治疗犬跳蚤感染,治疗和控制犬蜱感染。
[用法与用量]以沙罗拉纳计。口服:每lkg体重,犬2mg,每月1次。根据当地情况,在跳蚤、蜱虫流行季节持续给药。
|
体重(kg) |
药片规格 |
数量(片) |
|
1.3~2.5 |
5mg |
1 |
|
2.6~5 |
10mg |
1 |
|
5.1~10 |
20mg |
1 |
|
10.1~20 |
40mg |
1 |
|
20.1~40 |
80mg |
1 |
|
40.1~60 |
120mg |
1 |
|
>60 |
选择合适的规格组合使用 |
|
[不良反应]沙罗拉纳可能会引起异常的神经症状,如颤抖、本体感受意识减弱、共济失调、威胁反射减弱或消失和/或癫痫。
[注意事项](1)仅在善医指导下用药。
(2)仅用于6月龄及以上且体重不低于1.3kg的犬。
(3)尚未对种犬、妊娠和哺乳期犬进行安全性研究,应慎用。
(4)给药后应观察几分钟以确保动物服下全部剂量。如有漏服,重新给药。
(5)置于儿童和宠物不可触及处。
附件2
沙罗拉纳咀嚼片等6种兽药产品质量标准
一、 沙罗拉纳咀嚼片质量标准
沙罗拉纳咀嚼片
Shaluolana Jujuepian
Sarolaner Chewable Tablets
本品含沙罗拉纳(C23H18Cl2F4N2O5S)应为标示量的90.0%~110.0%。
【性状】 本品为带斑点的棕色方形片。
【鉴别】 (1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)照含量测定项下的色谱条件,用二极管阵列检测器在210~400nm波长范围内测定,供试品溶液主峰吸收图谱应与对照品溶液主峰的一致。
【检查】 有关物质 取含量测定项下的供试品溶液作为供试品溶液。照含量测定项下的色谱条件,精密量取5μl,注入液相色谱仪,记录色谱图。杂质A、B、C、D、E、F、G、H、I、J、K峰相对于沙罗拉纳峰的保留时间分别为0.40、0.49、0.77、0.83、0.87、0.92、0.94、1.29、1.47、1.56、1.83。供试品溶液色谱图中如有杂质峰,按峰面积归一化法计算,含单一已知杂质不得过1.0%,含已知杂质和未知杂质总和不得过3.0%。供试品溶液色谱图中溶剂峰、内标峰、任何小于定量限(0.1%)的峰以及工艺相关杂质峰(A、G、H、I、J和K)忽略不计。
含量均匀度 取本品1片,置20ml(5mg规格)、50ml(10mg规格)、100ml(20mg规格)、200ml(40mg规格)、400ml(80mg规格)、500ml(120mg规格)量瓶中,精密加入内标溶液(取羟苯乙酯约1.0g,精密称定,置1000ml量瓶,用丙酮溶解,并稀释至刻度)2ml(5mg规格)、5ml(10mg规格)、10ml(20mg规格)、20ml(40mg规格)、40ml(80mg规格)、50ml(120mg规格),用丙酮稀释至刻度,搅拌12小时,滤过或以每分钟8000转离心10分钟,取续滤液或上清液作为供试品溶液。取含量测定项下的对照品溶液作为对照品溶液。照含量测定项下的方法测定,按内标法以峰面积计算,应符合规定(附录0941)。
溶出度 取本品,照溶出度与释放度测定法(附录0931第二法),以含0.5%聚山梨酯80的0.2mol/L的磷酸盐缓冲溶液(取磷酸二氢钠无水物23.97g和氢氧化钠4.67g,加水966ml使溶解,用0.2mol/L氢氧化钠溶液调节pH值至6.8,加水至1000ml,加聚山梨酯80 5ml,搅拌使溶解,混匀,即得)900ml为溶出介质,转速为每分钟50转(5mg规格、10mg规格、20mg规格)或每分钟75转(40mg规格、80mg规格、120mg规格),温度为37±0.5℃,依法操作。经90分钟时,取溶液10ml,滤过,取续滤液(5mg规格)或续滤液进一步稀释的溶液[5ml(10mg规格)、5ml(20mg规格)、3ml(40mg规格)、3ml(80mg规格)、2ml(120mg规格),用溶出介质进一步稀释至10ml(10mg规格)、20ml(20mg规格)、25ml(40mg规格)、50ml(80mg规格)、50ml(120mg规格)],作为供试品溶液。另取沙罗拉纳对照品约50mg,精密称定,置50ml量瓶中,加甲醇-乙腈(50∶50)5ml,超声使溶解,放冷,用甲醇-乙腈(50∶50)稀释至刻度,摇匀,精密量取1ml,置200ml量瓶中,用溶出介质稀释至刻度,作为对照品溶液。照高效液相色谱法(附录0512),用十八烷基硅烷键合硅胶为填充剂(Gemini NX C18,4.6mm´150mm,3mm或效能相当的色谱柱),以0.1%三氟乙酸溶液(取三氟乙酸1ml加水至1000ml)为流动相A;以含0.1%三氟乙酸的甲醇-乙腈混合溶液[取三氟乙酸1ml加甲醇-乙腈溶液(75∶25)至1000ml]为流动相B;按下表进行梯度洗脱;检测波长为260nm;柱温为40±5℃;沙罗拉纳峰的拖尾因子应不得过2.0。精密量取供试品溶液和对照品溶液各10µl,注入液相色谱仪,记录色谱图。按外标法以峰面积计算每片的溶出量。限度为标示量的75%,应符合规定。
|
时间(分) |
流动相A(%) |
流动相B(%) |
|
0.0 |
40 |
60 |
|
15.0 |
14 |
86 |
|
15.1 |
5 |
95 |
|
16.0 |
5 |
95 |
|
16.1 |
40 |
60 |
|
20.0 |
40 |
60 |
水分 照水分测定法(附录0832第一法A)测定,含水分应不得过10.0%。
微生物限度 取本品10g,加入胰酪大豆胨液体培养基适量,混匀。照非无菌产品微生物限度检查:微生物计数法(附录1105平皿法)和控制菌检查法(附录1106),每1g供试品中需氧菌总数不得过103cfu;霉菌酵母菌总数不得过102cfu;不得检出大肠埃希菌和沙门菌。
【含量测定】 照高效液相色谱法(附录0512)测定。
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂(Gemini NX C18,4.6mm´150mm,3mm或效能相当的色谱柱);按溶出度项下的方法制备流动相A和流动相B,按下表进行梯度洗脱;检测波长为260nm;柱温为40±5℃;沙罗拉纳峰与相邻色谱峰的分离度应符合要求;沙罗拉纳峰的拖尾因子应在0.8~1.5之间。
|
时间(分) |
流动相A(%) |
流动相B(%) |
|
0.0 |
40 |
60 |
|
20.0 |
5 |
95 |
|
25.0 |
5 |
95 |
|
25.1 |
40 |
60 |
|
30.0 |
40 |
60 |
测定法 取本品12片(5mg规格)、12片(10mg规格)、12片(20mg规格),置250ml(5mg规格)、500ml(10mg规格)、1000ml(20mg规格)量瓶中,精密加入含量均匀度项下的内标溶液25ml(5mg规格)、50ml(10mg规格)、100ml(20mg规格),加丙酮稀释至刻度,搅拌12小时[取本品40片(40mg规格)、20片(80mg规格)、14片(120mg规格),精密称定,计算平均片重,研细,取1.5g,精密称定,置250ml量瓶中,精密加入内标溶液25ml,用丙酮稀释至刻度,搅拌12小时],滤过或以每分钟8000转离心10分钟,取续滤液或上清液作为供试品溶液;精密量取5μl,注入液相色谱仪,记录色谱图。另取沙罗拉纳对照品约62.5mg,精密称定,置250ml量瓶中,精密加入内标溶液25ml,加丙酮溶解,并稀释至刻度,摇匀,作为对照品溶液。按内标法以峰面积计算,即得。
【作用与用途】 异噁唑啉类抗寄生虫药。用于预防和治疗犬跳蚤感染,治疗和控制犬蜱感染。
【用法与用量】 以沙罗拉纳计。口服:每1kg体重,犬2mg,每月1次。根据当地情况,在跳蚤、蜱虫流行季节持续给药(具体详见说明书)。
【不良反应】 沙罗拉纳可能会引起异常的神经症状,如颤抖、本体感受意识减弱、共济失调、威胁反射减弱或消失和/或癫痫。
【注意事项】 (1)仅在兽医指导下用药。
(2)仅用于6月龄及以上且体重不低于1.3kg的犬。
(3)尚未对种犬、妊娠和哺乳期犬进行安全性研究,应慎用。
(4)给药后应观察几分钟以确保动物服下全部剂量。如有漏服,重新给药。
(5)置于儿童和宠物不可触及处。
【休药期】 不需要制定。
【规格】 (1)5mg (2)10mg (3)20mg (4)40mg (5)80mg (6)120mg
【包装】
【贮藏】 30℃以下贮存;40℃以下短途运输。
【有效期】 24个月。
【生产企业】 硕腾公司美国林肯生产厂
附注
1. 色谱图
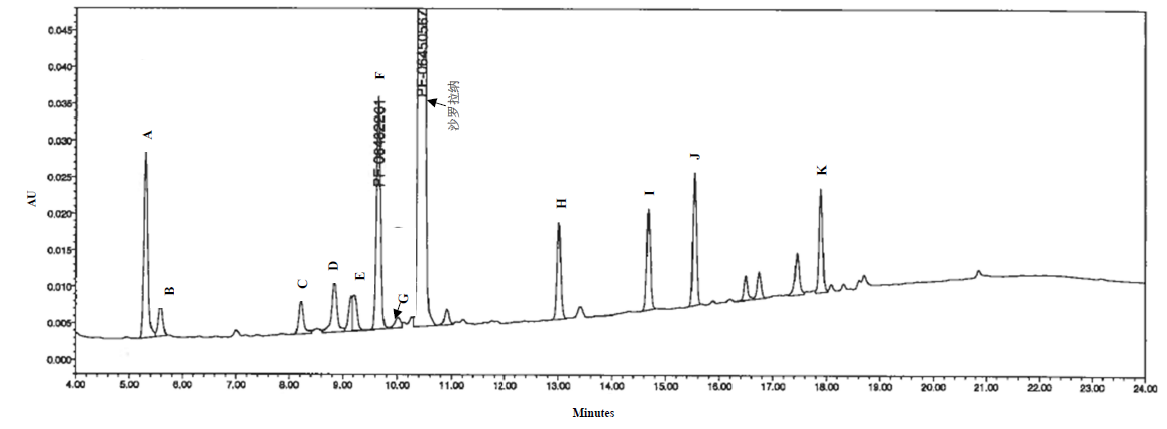
2. 杂质
杂质A
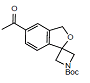
C17H21NO4 303.3
tert-Butyl5'-acetyl-3'H-spiro[azetidine-3,1'-isobenzofuran]-1-carboxylate
叔-丁基5'-乙酰-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃]-1-羧酸盐
杂质B
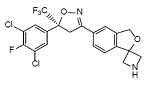
C20H14Cl2F4N2O2 461.238
(S)-5'-(5-(3,5-Dichloro-4-fluorophenyl)-5-(trifluoromethyl)-4,5-dihydroisoxazol-3-yl)-3'H-spiro[azetidine-3,1'-isobenzofuran]
(S)-5'-(5-(3,5-二氯-4-氟苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃]
杂质C
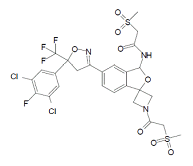
C26H23Cl2F4N3O8S2 716.51
N-(5'-((S)-5-(3,5-Dichloro-4-fluorophenyl)-5-(trifluoromethyl)-4,5-dihydroisoxazol-3-yl)-1-(2-(methylsulfonyl)acetyl)-3'H-spiro[azetidine-3,1'-isobenzofuran]-3'-yl)-2-(methylsulfonyl)acetamide
N-(5'-((S)-5-(3,5-二氯-4-氟苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-1-(2-(甲磺酰)乙酰)-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃]-3'-基)-2-(甲磺酰)乙酰胺
杂质D
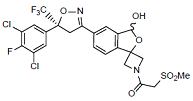
C23H19Cl2F4N2O6S 597.4
1-(5'-((S)-5-(3,5-Dichloro-4-fluorophenyl)-5-(trifluoromethyl)-4,5-dihydroisoxazol-3-yl)-3'-hydroxy-3'H-spiro[azetidine-3,1'-isobenzofuran]-1-yl)-2-(methylsulfonyl)ethenone
1-(5'-((S)-5-(3,5-二氯-4-氟苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-3'-羟基-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃]-1-基)-2-(甲磺酰)乙酮
杂质E
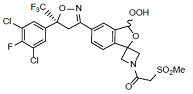
C23H19Cl2F4N2O7S 613.4
1-(5'-((S)-5-(3,5-Dichloro-4-fluorophenyl)-5-(trifluoromethyl)-4,5-dihydroisoxazol-3-yl)-3'-hydroperoxy-3'H-spiro[azetidine-3,1'-isobenzofuran]-1-yl)-2-(methylsulfonyl)ethenone
1-(5'-((S)-5-(3,5-二氯-4-氟苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-3'-过氧氢-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃]-1-基)-2-(甲磺酰)乙酮
杂质F
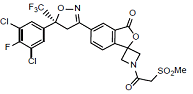
C23H17Cl2F4N2O6S 595.3
(S)-5'-(5-(3,5-Dichloro-4-fluorophenyl)-5-(trifluoromethyl)-4,5-dihydroisoxazol-3-yl)-1-(2-(methylsulfonyl)acetyl)-3'H-spiro[azetidine-3,1'-isobenzofuran]-3'-one
(S)-5'-(5-(3,5-二氯-4-氟苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-1-(2-(甲磺酰)乙酰)-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃]-3'-酮
杂质G
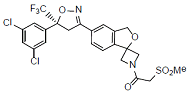
C23H19Cl2F3N2O5S 563.4
(S)-1-(5'-(5-(3,5-Dichlorophenyl)-5-(trifluoromethyl)-4,5-dihydroisoxazol-3-yl)-3'H-spiro[azetidine-3,1'-isobenzofuran]-1-yl)-2-(methylsulfonyl)ethenone
(S)-1-(5'-(5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃]-1-基)-2-(甲磺酰)乙酮
杂质H
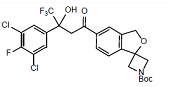
C25H23Cl2F4NO5 565.4
tert-Butyl 5'-(3-(3,5-dichloro-4-fluorophenyl)-4,4,4-trifluoro-3-hydroxybutanoyl)-3'H-spiro [azetidine-3,1'-isobenzofuran]-1-carboxylate
叔-丁基5'-(3-(3,5-二氯-4-氟苯基)-4,4,4-三氟-3-羟基丁氧基)-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃]-1-羧酸盐
杂质I
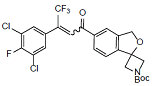
C25H21Cl2F4NO4 546.3
tert-Butyl 5'-(3-(3,5-dichloro-4-fluorophenyl)-4,4,4-trifluorobut-2-enoyl)-3'H-spiro [azetidine-3,1'-isobenzofuran]-1-carboxylate
叔-丁基5'-(3-(3,5-二氯-4-氟苯基)-4,4,4-三氟丁烷-2-烯酰)-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃]-1-羧酸盐
杂质J
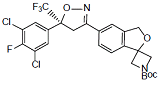
C25H22Cl2F4N2O4 561.35
(S)-tert-Butyl 5'-(5-(3,5-dichloro-4-fluorophenyl)-5-(trifluoromethyl)-4,5-dihydroisoxazol-3-yl) -3'H-spiro[azetidine-3,1'-isobenzofuran]-1-carboxylate
(S)-叔-丁基5'-(5-(3,5-二氯-4-氟苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃]-1-羧酸盐
杂质K
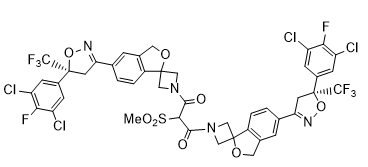
C44H30Cl4F8N4O8S 1068.59
1,3-bis(5'-((S)-5-(3,5-dichloro-4-fluorophenyl)-5-(trifluoromethyl)-4,5-dihydroisoxazol-3-yl)-3'H-spiro[azetidine-3,1'-isobenzofuran]-1-yl)-2-(methylsulfonyl)propane-1,3-dione
1,3-双(5'-((S)-5-(3,5-二氯-4-氟苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-3'H-螺[氮杂环丁烷-3,1'-异苯并呋喃] -1-基)-2-(甲基磺酰基)丙烷-1,3-二酮
二、肉鸡球虫活疫苗质量标准
肉鸡球虫活疫苗
Rouji Qiuchong Huoyimiao
Coccidiosis Vaccine , Live Oocysts, Chicken Isolates
本品系用巨型、变位、堆型、柔嫩艾美耳球虫虫种分别接种鸡,收获卵囊,加入重铬酸钾溶液混合制成。用于预防肉鸡球虫病。
【性状】 黄色至棕色悬液。
【无菌检验】 按现行《中国兽药典》三部附录进行检验,应无菌生长。
|
检验次数 |
检验鸡数 |
允许的失败鸡数 |
|
|
合格产品 |
不合格产品 |
||
|
1 |
25 |
≤2 |
≥4 |
|
2 |
50 |
≤5 |
≥6 |
【安全检验】 取1~14日龄SPF鸡25只,分别口服接种疫苗2羽份,平养,观察21日。如出现严重的球虫病症状或死亡,记作“失败”。如第一次检验中有3只鸡记作“失败”,则需进行第二次检验。第二次检验中取鸡50只。最终判定如下表所示:
【效力检验】 取1~14日龄SPF鸡45只,其中25只分别饮水接种疫苗1羽份,另20只不接种作为对照。接种后14日内,垫料需保持一定湿度(如果试验鸡笼或垫料太干,应在14日后再接种疫苗1羽份)。接种后28日,随机选取上述免疫鸡和对照鸡各20只,分成4组(每组5只免疫鸡和5只对照鸡),每组以一种艾美耳球虫卵囊悬液1.0ml口服攻虫。各虫种的攻虫量至少为:巨型艾美耳球虫45000个卵囊、变位艾美耳球虫300000个卵囊、堆型艾美耳球虫300000个卵囊、柔嫩艾美耳球虫20000个卵囊。
攻虫后5~6日,扑杀所有鸡,检查小肠及盲肠病变,并记分(病变计分标准见附注)。所有免疫鸡的病变记分均应≤1,每组对照鸡中应至少有4只鸡的病变记分为2~4分。
【作用与用途】 用于预防肉鸡球虫病。
【用法与用量】 (1)用于1日龄肉鸡喷雾接种。按每1000羽份用蒸馏水稀释至210ml的比例进行稀释,用专用喷雾器喷雾,每100只鸡21ml稀释后的疫苗溶液。
(2)用于1~3日龄肉鸡喷料接种。按每1000羽份用蒸馏水稀释至400ml的比例进行稀释。将稀释好的疫苗均匀喷于饲料表面,供自由采食。
【注意事项】
(1) 仅用于接种平养的健康肉鸡。
(2) 接种前、后24小时内,不得使用抗球虫药和消毒剂。
(3) 接种后,应保持鸡舍垫料具有一定湿度。
(4) 疫苗一旦开启,应一次用完。
(5) 用过的疫苗瓶和稀释后剩余的疫苗应焚毁。
(6) 屠宰前21日内禁用。
【规格】 (1)4ml(1000羽份)/瓶 、(2)10ml(10000羽份)/瓶
【贮藏与有效期】 2~8℃避光保存,有效期为9个月。
【生产企业】 英特威美国分公司(Intervet Inc.)
地址 ROUTE 411 West Delaware Avenue Millsboro, Delaware 19966
附注
病变记分标准
|
球虫种 |
1分 |
2分 |
3分 |
4分 |
|
巨型艾美耳球虫 |
整个小肠段有小淤血点 |
桔黄色粘液;整个小肠壁增厚 |
小肠壁膨胀 |
小肠极度膨胀,伴有粘膜出血;死亡 |
|
变位艾美耳球虫 |
整个小肠段有小淤血点,特别是前1/2段 |
整个小肠有白色病变,特别是前半段 |
整个小肠有白色病变和水肿,特别是前半段 |
白色出血性病变;融合;死亡 |
|
堆型艾美耳球虫 |
十二指肠有小淤血点 |
十二指肠和小肠前半段有白色病变 |
在小肠前半段有白色病变;水肿 |
出血;白色病变;融合;死亡 |
|
柔嫩艾美耳球虫 |
很少有小淤血点 |
小肠有小淤血点;盲肠壁增厚 |
盲肠内轻度出血 |
盲肠壁变薄,盲肠内充满血液或肠芯 |
三、地克珠利混悬液质量标准
地克珠利混悬液
Dikezhuli Hunxuanye
Diclazuril Suspension
本品含地克珠利(C17H9Cl3N4O2)应为标示量的95.0%~105.0%。
【性状】 本品振摇后为均匀的白色至类白色混悬液。
【鉴别】 (1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)取本品1ml,置10ml量瓶中,加二甲基甲酰胺6ml,振摇15分钟使溶解,用二甲基甲酰胺稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液。另取地克珠利对照品约25mg,置100ml量瓶中,加二甲基甲酰胺振摇使溶解并稀释至刻度,摇匀,作为对照品溶液。照薄层色谱法(附录050页)试验,吸取上述两种溶液各10µl,分别点于同一硅胶KC18薄层板上,以1,4-二氧六环-1mol/L醋酸铵溶液(60∶40)为展开剂,展开,晾干,置紫外灯(254nm)下检视,供试品溶液所显主斑点的位置和颜色应与对照品溶液的主斑点相同。
(3)在羟苯甲酯、羟苯丙酯检查项下记录的色谱图中,供试品溶液两主峰的保留时间应与对照品溶液两主峰的保留时间一致。
以上(1)、(2)两项可选做一项。
【检查】 相对密度 本品的相对密度(附录0601)为1.000~1.012。
pH值 取本品摇匀,依法测定(附录0631),应为3.5~5.5。
粒度 取本品,振摇5分钟,量取20µl,置载玻片上,覆以盖玻片(22×22mm),置显微镜下观察,检视约含2µg地克珠利视野内的颗粒,100µm以上的颗粒不得过5粒;75µm以上的颗粒不得过10粒;50µm以上的颗粒不得过25粒。
有关物质 取含量测定项下的供试品溶液作为供试品溶液;另取地克珠利对照品约0.1g,精密称定,置100ml量瓶中,加二甲基甲酰胺使溶解并稀释至刻度,摇匀,作为对照品贮备液;取地克珠利降解产物对照品(R064318)约25mg,精密称定,置25ml量瓶中,加二甲基甲酰胺使溶解并稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,用二甲基甲酰胺稀释至刻度,摇匀,精密量取5ml,置100ml量瓶中,精密加地克珠利对照品贮备液和含量测定项下内标溶液各10ml,用二甲基甲酰胺稀释至刻度,摇匀,作为对照品溶液。照含量测定项下的色谱条件试验,精密量取对照品溶液2µl注入液相色谱仪,记录色谱图。地克珠利色谱峰相对于内标物峰的保留时间约为1.32,地克珠利降解产物峰相对于内标物峰的保留时间约为1.50,对照品溶液色谱图中地克珠利峰与降解产物峰的分离度应符合规定。计算降解产物对照品峰面积与内标物峰面积的校正因子。精密量取供试品溶液20µl注入液相色谱仪,记录色谱图至地克珠利峰保留时间的2倍。另取本品,摇匀,同时测定其相对密度,将供试品量换算成毫升数。供试品溶液色谱图中如有杂质峰,扣除二甲基甲酰胺溶剂峰和相对保留时间约为0.40和0.55的辅料峰,按内标法计算,与对照品溶液色谱图中的降解产物峰保留时间一致的杂质和其他单个杂质均不得大于0.5%,各杂质的和不得大于1.0%。
羟苯甲酯、羟苯丙酯 取羟苯甲酯对照品约180mg、羟苯丙酯对照品约20mg,分别精密称定,置同一100ml量瓶中,加甲醇适量使溶解并稀释至刻度,摇匀,精密量取3ml,置50ml量瓶中,精密加对羟基苯甲酸乙酯内标溶液(取对羟基苯甲酸乙酯100mg,置100ml量瓶中,用乙醇稀释至刻度,摇匀,即得)3ml,用乙醇稀释至刻度,摇匀。照高效液相色谱法(附录0512)试验,用十八烷基键合硅胶为填充剂,流动相为0.5%甲酸溶液-乙腈(62:38),流速为每分钟2.0ml,检测波长为254nm。羟苯甲酯峰与内标物峰的分离度不得小于2.2;羟苯丙酯峰与内标物峰的分离度不得小于4.5。精密量取10µl注入液相色谱仪,记录色谱图,羟苯甲酯峰、羟苯丙酯峰相对于内标物峰的保留时间分别约为0.70与1.60,计算各自的校正因子。取摇匀后的本品约3g,精密称定,置50ml量瓶中,精密加内标溶液3ml,加乙醇适量使溶解并稀释至刻度,摇匀,作为供试品溶液。另取本品,摇匀,同时测定相对密度,将供试品量换算成毫升数,按内标法计算,即得。每1ml含羟苯甲酯应为1.62~1.98mg,含羟苯丙酯应为0.16~0.22mg。
微生物限度 取本品10ml,加酪蛋白大豆肉汤90ml,混匀,作为供试品溶液。分别取供试品溶液1ml置两个酪蛋白大豆琼脂培养皿中,30~35℃培养5天,分别计算需氧微生物数,求其平均值。另各取供试品溶液1ml分别置两个沙氏葡萄糖琼脂培养皿中,20~25℃培养5天,分别计算霉菌和酵母菌总数,求其平均值。另取供试品溶液10ml,加酪蛋白大豆肉汤90ml,摇匀,30~35℃培养18~24小时,取培养物1ml置100ml麦康凯肉汤培养基中,摇匀,42~44℃培养24~48小时,随后在麦康凯琼脂培养基中30~35℃继续培养至少24小时。每1ml供试品中需氧微生物总数不得过102cfu,酵母菌和霉菌总数不得过101cfu,大肠杆菌不得检出。
其他 应符合内服混悬剂项下有关的各项规定(附录0111)。
【含量测定】 照高效液相色谱法(附录0512)测定。
色谱条件与系统适用性试验 用十八烷基键合硅胶为填充剂;0.2%磷酸溶液-乙腈(43∶57)为流动相;流速为每分钟2.0ml;检测波长为280nm。地克珠利峰与内标物峰之间的分离度应不小于4.3。
校正因子的测定 取地克珠利内标物(R062690)适量,加二甲基甲酰胺溶解并稀释制成每1ml含1mg的溶液,作为内标溶液。另取地克珠利对照品约0.1g,精密称定,置100ml量瓶中,加二甲基甲酰胺振摇使溶解并稀释至刻度,摇匀,精密量取10ml,置100ml量瓶中,精密加内标溶液10ml,用二甲基甲酰胺稀释至刻度,摇匀,精密量取20µl,注入液相色谱仪,计算校正因子。
测定法 取摇匀后的本品约4g,精密称定,置100ml量瓶中,精密加内标溶液10ml,加二甲基甲酰胺振摇使溶解并稀释至刻度,摇匀,滤过,续滤液作为供试品溶液。精密量取供试品溶液20µl,注入液相色谱仪,记录色谱图;另取本品,摇匀,同时测定相对密度,将供试品量换算成毫升数,按内标法峰面积计算,即得。
【作用与用途】 抗球虫药。用于预防因牛艾美耳球虫、邱氏艾美耳球虫、阿拉巴艾美耳球虫和柱状艾美耳球虫等引起的犊牛球虫病。
【用法与用量】 以本品计。单次经口给药:每2.5kg体重,犊牛1ml。
【不良反应】 无。
【注意事项】 1.使用前充分摇匀。
2.请勿冷冻,产品一旦开启应在3个月内用完。
3.置于儿童无法接触的地方。
4.未用完的产品以及废弃物应进行无害化处理。
5.单次给予犊牛5倍推荐剂量的药物后,未见药物过量症状。如给予3~5倍推荐剂量的药物,连用3天,一些犊牛可能出现软便以及粪便颜色的改变(暗褐色),但这些结果表现为一过性,不需要特殊治疗。
6.如不存在近期和确定的临床球虫病病史,那么以已知的艾美耳球虫流行病学为指导来确定首次的治疗时间,并且在治疗前采集粪便样本以确定畜群中是否存在球虫。
7.球虫病是圈舍卫生环境不合格的一项指标,建议改善卫生环境并对圈舍中的所有犊牛进行治疗。
8.对因感染球虫出现腹泻的犊牛,应给予辅助性对症治疗。
【休药期】 犊牛0日。
【规格】 0.25%
【包装】
【贮藏】 5℃~30℃,密闭保存。
【有效期】 36个月。
【生产企业 Lusomedicamenta药业技术有限公司(Lusomedicamenta-Technical Pharmaceutical Society., A.S.)
附注
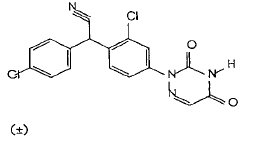
1.地克珠利内标物(R062690)
(±)-2-氯-α-(4-氯苯基)-4-(4,5-二氢-3,5-二氧-1,2,4-三嗪-2(3H)-基 )苯乙腈
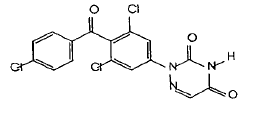
2.地克珠利降解产物(R064318)
2-[3,5-二氯-4-(4-氯苯甲酰基)苯基]-l,2,4-三嗪- 3,5(2H,4H)-二酮
3.灭菌酪蛋白大豆肉汤的配制
酪蛋白胨 17.0g
大豆蛋白胨 3.0g
氯化钠 5.0g
磷酸氢二钾 2.5g
葡萄糖 2.5g
纯化水 1000ml
调节pH值使灭菌后(25℃ 时)为7.3±0.2。
4.灭菌酪蛋白大豆琼脂的配制
酪蛋白胰酶消化物 15.0g
大豆木瓜酶消化物 5.0g
氯化钠 5.0g
琼脂 15.0g
纯化水 1000ml
调节pH值使灭菌后(25℃ 时)为7.3±0.2。
5.灭菌沙氏葡萄糖琼脂的配制
葡萄糖 40.0g
酪蛋白胰酶消化物和动物组织胰腺消化物的混合物(1︰1) 10.0g
琼脂 15.0g
纯化水 1000ml
调节pH值使灭菌后(25℃时)为5.6±0.2。
6.灭菌麦康凯肉汤的配制
明胶胰腺消化物 20.0g
水合乳糖 10.0g
脱水牛胆汁 5.0g
溴甲酚紫 10mg
纯化水 1000ml
调节pH值使灭菌后(25℃时)为7.3±0.2。
7.灭菌麦康凯琼脂的配制
明胶胰腺消化物 17.0g
酪蛋白胨 3.0g
水合乳糖 10.0g
氯化钠 5.0g
胆盐 1.5g
中性红 30.0mg
结晶紫 1mg
琼脂 13.5g
纯化水 1000ml
调节pH值使灭菌后(25℃时)为7.1±0.2。
四、鸡减蛋综合征灭活疫苗(127株)质量标准
鸡减蛋综合征灭活疫苗(127株)
Ji Jiandanzonghezheng Miehuoyimiao (127 Zhu)
Egg Drop Syndrome Vaccine,Inactivated(Strain 127)
本品系用禽凝血性腺病毒127株接种易感鸭胚培养,收获感染鸭胚液,用甲醛溶液灭活后,加矿物油佐剂混合乳化制成。用于预防鸡减蛋综合征。
【性状】 外观 乳白色乳剂。
剂型 油包水型。取一清洁吸管,吸取少量疫苗滴于冷水中,除第1滴外,均应不扩散。
稳定性 吸取疫苗10ml加入离心管中,以3000r/min离心15分钟,管底析出的水相应不超过0.5ml。
黏度 按现行《中国兽药典》附录进行检验,应符合规定。
【装量检查】 按现行《中国兽药典》三部附录进行检验,应符合规定。
【无菌检验】 按现行《中国兽药典》三部附录进行检验,应无菌生长。
【安全检验】 用21~42日龄SPF鸡10只,各肌肉注射疫苗1.0ml,逐日观察14日,应不出现由疫苗而引起的任何局部和全身不良反应。
【效力检验】 用21~42日龄的SPF鸡10只,各肌肉或皮下注射疫苗0.5ml,另10只作为对照。接种后28日,连同对照鸡分别采血,分离血清,测定HI抗体效价。免疫鸡HI抗体效价的几何平均值应不低于1∶128,对照鸡HI抗体效价均应不高于1∶4。
【甲醛、汞类防腐剂残留量测定】 按现行《中国兽药典》附录进行测定,应符合规定。
【作用与用途】 用于预防鸡减蛋综合征。
【用法与用量】 用于皮下(颈背部)或肌肉(胸部肌肉)注射种鸡或蛋鸡,每只1羽份(0.5ml)。建议在18~20周龄时进行接种,或者在开产前4~6周时进行接种。
【注意事项】 (1)应在兽医的指导下使用本疫苗。
(2)疫苗置2~8℃保存,严禁冻结。
(3)疫苗仅用于接种健康鸡。
(4)避免将疫苗暴露于高温下和阳光直接照射。
(5)在使用前应将疫苗放至室温(15~20℃),并在使用前和使用过程中充分摇匀。
(6)应使用灭菌的接种器具。
(7)应避免将疫苗注入人体内。如误将疫苗注入接种的人员体内,可引起一系列的局部反应。应立即就医。并告知医生本品为油乳剂。
(8)疫苗瓶和未用完的疫苗液应焚烧或煮沸处理。
【规格】 (1)250ml/瓶 (2)500ml/瓶
【贮藏与有效期】 2~8℃保存,有效期为15个月。
【生产企业】 以色列雅贝克生物实验有限公司 (ABIC Biological Laboratories Ltd.)
五、复方戊二醛溶液质量标准
复方戊二醛溶液
Fufang Wu’erquan Rongye
Compound Glutaral Solution
本品为戊二醛、苯扎氯铵和适宜辅料配制而成的水溶液。含戊二醛(C5H8O2)应为14.0%~16.0%(g/ml),含烃铵盐以C22H40ClN计应为9.0~11.0%(g/ml)。
【处方】 戊二醛 15.0g
苯扎氯铵 10.0g
染料0.002g
香料 1.5g
水适量
全量 100ml
【性状】 本品为琥珀色的澄清液体,有特臭。
【鉴别】 (1)取2mol/L氢氧化钠溶液5ml,加溴酚蓝指示液0.1ml和三氯甲烷5ml,振摇,静置分层,加入本品0.25ml,振摇,三氯甲烷层由无色变为蓝色。
(2)取本品约1.5ml,置试管中,加氨制硝酸银试液1ml,置水浴中加热数分钟后,生成细微的灰色沉淀,或在管壁生成光亮的银镜。
【检查】 相对密度 本品的相对密度(附录0601)为1.030~1.040。
酸度 精密量取本品20ml,加水10ml与溴麝香草酚蓝指示液8滴,用氢氧化钠滴定液(0.1mol/L)滴定至溶液由橙黄色变为黄色,消耗氢氧化钠滴定液(0.1mol/L)不得过3.0ml。
【含量测定】 戊二醛 取本品适量(约相当于戊二醛0.2g),精密称定,精密加入6.5%三乙醇胺溶液20ml与盐酸羟胺的中性溶液(取盐酸羟胺17.5g加水75ml溶解,加异丙醇稀释至500ml,摇匀;加0.04%溴酚蓝的乙醇溶液15ml,用6.5%三乙醇胺溶液滴定至溶液显蓝绿色)25ml,摇匀;放置1小时,用硫酸滴定液(0.25mol/L)滴定至溶液显蓝绿色,并将滴定的结果用空白试验校正。另取本品,同时测其相对密度,将供试品量换算成毫升数。每1ml硫酸滴定液(0.25mol/L)相当于25.03mg的C5H8O2。
苯扎氯铵 取本品适量(约相当于苯扎氯铵0.5g),精密称定,置烧杯中,用水35ml定量转移至250ml分液漏斗中,加0.1mol/L氢氧化钠溶液10ml与三氯甲烷25ml,精密加入新制的5%碘化钾溶液10ml,振摇,静置使分层,水层用三氯甲烷提取3次,每次10ml,弃去三氯甲烷层,水层移入250ml具塞锥形瓶中,用水约15ml淋洗分液漏斗,合并洗液和水液,加盐酸40ml,放冷,用碘酸钾滴定液(0.05mol/L)滴定至淡棕色,加三氯甲烷5ml,继续滴定并剧烈振摇至三氯甲烷层无色,并将滴定的结果用空白试验校正。另取本品,同时测其相对密度,将供试品量换算成毫升数。每1ml碘酸钾滴定液(0.05mol/L)相当于35.40mg的C22H40ClN。
【作用与用途】 消毒防腐药。主要用于动物厩舍及器具消毒。
【用法与用量】 1∶150倍稀释。喷洒:每平方米9ml;涂刷:无孔材料表面,每平方米100ml;有孔材料表面,每平方米300ml。
特定疾病的使用浓度:禽流感/新城疫,1∶150倍稀释;传染性法氏囊,1∶200倍稀释;口蹄疫,1∶80倍稀释;猪水泡,1∶300倍稀释。
【注意事项】 1.易燃。
2.禁与阴离子表面活性剂及盐类消毒药合用。
3.不宜用于膀胱镜、眼科器械及合成橡胶制品的消毒。
4.需在通风良好的场所进行稀释。使用时须谨慎,避免眼睛或皮肤接触本品,避免吸入其挥发气体,以免被灼烧或引起过敏反应或呼吸道问题。
5.过敏人群(喘气患者、慢性支气管炎患者等)应避免接触高浓度本品。使用时需配备防护设备如防护衣、手套、护面和护眼用具等。
6.勿与食物或饲料混合,避免意外吞食。若不慎误食,需迅速就医。
7.若皮肤或眼睛不慎接触本品,立即用大量清水冲洗并迅速就医。
8.本品对水生环境有毒,禁止向下水道或者环境直接排放。
9.废弃溶液及包装的处理应符合相关规定。
【规格】 100ml∶戊二醛15g+苯扎氯铵10g
【包装】
【贮藏】 遮光,密闭保存。
【有效期】 24个月。
【生产企业】 英国考文垂化学药品有限公司(Coventry Chemicals Limited,United Kingdom)
六、土霉素注射液质量标准
土霉素注射液
Tumeisu Zhusheye
Oxytetracycline Injection
本品为土霉素二水合物与N-甲基吡咯烷酮等制成的无菌水溶液。含土霉素二水合物以土霉素计(C22H24N2O9)应为标示量的90.0%~110.0%。
【性状】 本品为黄色至红棕色粘稠液体。
【鉴别】 (1)取本品1ml,加硫酸2ml,即显朱红色。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】 相对密度 本品的相对密度(附录0601)应为1.11~1.13。
pH值 应为8.2~8.8(附录0631)。
二水甲醛合次硫酸氢钠 取本品约5.6g,精密称定,迅速加入16.6%碘化钾溶液2ml,2%淀粉溶液2ml,2mol/L盐酸20ml和水20ml。立即用高锰酸钾滴定液(0.01mol/L)滴定至溶液显蓝色。每1ml高锰酸钾滴定液(0.01mol/L)相当于1.926mg的CH3NaO3S·2H2O。每1ml中含二水甲醛合次硫酸氢钠的量应为0.1~5.5mg。
无菌 取本品,加灭菌水制成每1ml中含20mg的溶液,用薄膜过滤法处理后,依法检查(附录1101),应符合规定。
其他 应符合注射剂项下有关的各项规定(附录0102)。
【含量测定】 照高效液相色谱法(附录0512)测定。
色谱条件与系统适用性试验 用PLRP-S为填充剂(Polymer Laboratories 4.6mm ×250mm,5μm或效能相当的色谱柱);以叔丁醇磷酸盐缓冲液等为流动相;柱温为60±2℃;检测波长为254nm。理论板数按土霉素峰计算应不低于1500,土霉素峰与相邻杂质峰的分离度应符合规定。
测定法 取本品约0.13g,精密称定,置100ml量瓶中,加入0.01mol/L盐酸溶液50ml,用0.01mol/L乙二胺四醋酸二钠溶液稀释至刻度,摇匀,作为供试品溶液;另取土霉素对照品125mg,精密称定,置100ml量瓶中,加0.1mol/L盐酸溶液5ml使溶解后,加水45ml,用0.01mol/L乙二胺四醋酸二钠溶液稀释至刻度,摇匀,精密量取10ml,置50ml量瓶中,加0.01mol/L乙二胺四醋酸二钠溶液10ml,用水稀释至刻度,作为对照品溶液。精密量取供试品溶液和对照品溶液各20μl,注入液相色谱仪,记录色谱图。按外标法以峰面积计算,即得。
【作用与用途】 四环素类抗生素。用于治疗猪革兰氏阳性菌、革兰氏阴性菌及支原体引起的感染。
【用法与用量】 以本品计。皮下或肌内注射:每10kg体重,猪1ml,72小时后注射一次。
【不良反应】 注射部位会发生短暂的肿胀和/或黄斑(和局部坏死),注射后黄斑会持续几日。皮肤不好的动物使用后,当在强光下暴露时,会发展成光照性皮炎。
【注意事项】
1.对四环素过敏、肾脏和肝脏有疾病者禁用。
2.使用过程中请避免污染;若发现有异物或变色请遗弃该药物。
3.本品不得在怀孕的最后2~3周使用。
4.本品不可与青霉素、头孢菌素同时使用。
5.避免皮肤接触。
6.该药物不可和肌肉神经阻断剂联合使用。
7.每个部位最高注射剂量不超过7ml。
【休药期】 猪35日。
【规格】 100ml∶20g
【贮藏】 遮光、密闭,25℃以下保存。
【有效期】 30个月。
【生产企业】 荷兰优诺威动物保健公司(Eurovet Animal Health BV)
附注
叔丁醇磷酸盐缓冲液的制备 取叔丁醇60.0g,置于1000ml量瓶中,加水200ml,加0.33mol/ L的磷酸盐缓冲液(pH7.5)(取十二水磷酸氢二钠6.08g和磷酸二氢钾0.41g,加水使溶解并稀释至60ml,调节pH至7.5)60ml和1.0%的硫酸氢化四丁基胺溶液(用2mol/ L氢氧化钠溶液调pH值至7.5)50ml,加0.04%乙二胺四醋酸二钠(用2mol/ L 氢氧化钠溶液调pH值至7.5)10ml,加水稀释至刻度。
相关新闻
- 中华人民共和国农业农村部公告第469号 2021-12-07
- 中华人民共和国农业农村部公告第474号 2021-12-07
- 中华人民共和国农业农村部公告第355号 2021-01-29
- 中华人民共和国农业农村部公报第332号 2020-11-30
- 中华人民共和国农业农村部公告第322号 2020-11-24



 提示信息
提示信息