中华人民共和国农业农村部公告第253号
根据《兽药管理条例》和《兽药注册办法》规定,经审查,批准山东滨州沃华生物工程有限公司等24 家单位申报的鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)等6种兽药产品为新兽药,核发《新兽药注册证书》,发布产品试行规程、质量标准、说明书和标签,自发布之日起执行。
批准宁波三生生物科技有限公司等3家单位申报的氨基丁三醇前列腺素F2α注射液等2种兽药产品变更注册,发布修订后的氨基丁三醇前列腺素F2α注射液质量标准、说明书和标签,自发布之日起执行,原我部发布的该产品质量标准、说明书和标签同时废止;发布修订后的维他昔布咀嚼片质量标准、说明书和标签,自发布之日起执行,新增靶动物猫监测期5年。
特此公告。
附件:1.新兽药注册目录
2.试行规程
3.质量标准
4.说明书和标签
农业农村部
2019年12月30日
附件1
新兽药注册目录
|
新兽药名称 |
研制单位 |
类别 |
新兽药注册证书号 |
监测期 |
备注 |
|
鸡传染性鼻炎(A型、C型)二价灭活疫苗( YT株+JN株) |
山东滨州沃华生物工程有限公司、 山东德利诺生物工程有限公司、山西隆克尔生物制药有限公司
|
三类 |
(2019)新兽药证字72号 |
3年 |
注册 |
|
非洲猪瘟病毒荧光等温扩增检测试剂盒 |
北京森康生物技术开发有限公司、中国动物疫病预防控制中心、青岛森康生物科技有限公司 |
三类 |
(2019)新兽药证字73号 |
3年 |
注册 |
|
非洲猪瘟病毒荧光PCR检测试剂盒 |
中国检验检疫科学研究院、北京世纪元亨动物防疫技术有限公司、哈尔滨元亨生物药业有限公司、天禾生物技术研究院(珠海)有限公司 |
三类 |
(2019)新兽药证字74号 |
3年 |
注册 |
|
鳜传染性脾肾坏死病灭活疫苗(NH0618株) |
中山大学、广东永顺生物制药股份有限公司、广州渔跃生物技术有限公司、北京时信成生物科技有限公司、广东渔跃生物技术有限公司 |
一类 |
(2019)新兽药证字75号 |
3年 |
注册 |
|
七味消滞颗粒 |
西安雨田农业科技有限公司、河北地邦动物保健科技有限公司、湖北武当动物药业有限责任公司、四川德成动物保健品有限公司、河当北新世纪药业有限公司、济南亿民动物药业有限公司、福建贝迪药业有限公司 |
三类 |
(2019)新兽药证字76号 |
3年 |
|
|
复方过硫酸氢钾枸橼酸粉 |
北京大北农动物保健有限责任公司、韶山大北农动物药业有限公司 |
三类 |
(2019)新兽药证字77号 |
3年 |
注册 |
|
氨基丁三醇前列腺素F2a注射液 |
宁波三生生物科技有限公司 |
二类 |
(2017)新兽药证字17号 |
/ |
变更注册:增加规格10ml :前列腺素F2x50mg规格;已有的3个规格增加西林瓶包装 |
|
维他昔布咀嚼片 |
青岛欧博方医药科技有限公司、 北京欧博方医药科技有限公司 |
一类 |
(2016)新兽药证字22号 |
新增靶动物猫监测期5年 |
变更注册:增加靶动物猫 |
附件2
鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)等4种兽药产品制造及检验试行规程
一、鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)制造及检验试行规程
本品系用副鸡禽杆菌A型YT株和C型JN株分别接种于适宜培养基培养,收获培养物,用硫柳汞灭活后浓缩,加氢氧化铝胶制成。用于预防由A型和C型副鸡禽杆菌引起的鸡传染性鼻炎。
1 菌种
1.1 制造和检验用菌种为副鸡禽杆菌YT株和JN株,均由山东滨州沃华生物工程有限公司鉴定、保管和供应。
1.2 菌种标准
1.2.1 形态和生化特性 为革兰氏阴性球杆菌或小杆菌。生化特性应符合细菌分类学中本菌的特性。
1.2.2 培养特性
1.2.2.1 在营养肉汤琼脂培养基上不生长;在含15μg/ml NADH(辅酶I)和5%健康鸡血清的鸡肉汤培养基中,置37℃静止培养,呈均匀一致的混浊状生长;在含15μg/ml NADH和10%健康鸡血清的鸡肉汤琼脂平板上,置5%CO2,37℃培养16~24小时,形成直径0.3mm左右、圆形、光滑、灰白色、半透明露珠样菌落,用低倍显微镜以45度折光观察具有较强的荧光。
1.2.2.2 在无还原型辅酶I(NADH)的鸡肉汤血琼脂平板与金黄色葡萄球菌交叉划线,置5%CO2条件下,37℃培养24~48小时,在葡萄球菌周围会生长出卫星菌落。
1.2.3 血清学特性 用血凝(HA)方法和血凝抑制(HI)方法(附注1)进行鉴定,YT株血清型为A型,JN株血清型为C型。
1.2.4 毒力
1.2.4.1 对鸡胚的毒力 取5~6日龄SPF鸡胚各10枚,分别卵黄囊内接种副鸡禽杆菌YT株或JN株的16小时鸡肉汤培养物,每胚0.2ml(含活菌300CFU),置37℃继续孵化,均应在30小时内10/10死亡。
1.2.4.2 对鸡的毒力
1.2.4.2.1 取7~9周龄SPF鸡10只,分别眶下窦内注射副鸡禽杆菌YT株菌液0.2ml(含活菌数约为4.0×104~ 2.0×105CFU),攻毒后连续观察7日,应至少8只发病(攻毒鸡出现面部一侧或两侧眶下窦及周围肿胀或流鼻涕任一症状即判为发病)。
1.2.4.2.2 取7~9周龄SPF鸡10只,分别眶下窦内注射副鸡禽杆菌JN株菌液0.2ml(含活菌数约为6.0×104~2.0×105CFU),攻毒后连续观察7日,应至少8只发病(攻毒鸡出现面部一侧或两侧眶下窦及周围肿胀或流鼻涕任一症状即判为发病)。
1.2.5 免疫原性 按本试行规程制备疫苗(每毫升疫苗含副鸡禽杆菌菌数2.0×109CFU)。用4~6周龄SPF鸡10只,各颈部皮下注射疫苗0.5ml,免疫后21日,连同条件相同的对照鸡10只,分别眶下窦内注射1个最小发病量对应制苗用菌株YT株0.2ml或JN株0.2ml,观察7日。各对照组应至少8只发病(攻毒鸡出现面部一侧或两侧眶下窦及周围肿胀或流鼻涕任一症状即判为发病),各免疫组应至少8只保护。
1.2.6 纯粹 将菌种接种TG小管2支,每支0.2ml,1支置35~37℃培养,1支置23~25℃培养,观察5日,应无菌生长;同时取菌种接种含15μg/ml NADH(辅酶I)和5%健康鸡血清的鸡肉汤琼脂斜面小管2支,每支0.2ml,1支置35~37℃、5%CO2培养,1支置23~25℃、5%CO2培养,观察5日,应纯粹生长。
1.2.7 基础种子代数 5~10代。
1.3 菌种保存 冻干菌种-40℃以下保存,保存期为48个月。
2 疫苗制造及半成品检验
2.1 生产用种子制备
2.1.1 一级种子繁殖 将副鸡禽杆菌YT株或JN株菌种分别划线接种含15μg/ml NADH和10%健康鸡血清的鸡肉汤琼脂平板,置5%CO2环境下37℃培养16~24小时,挑选数个荧光性强的典型菌落,用鸡肉汤液体培养基悬浮后,分别接种于5~6日龄SPF鸡胚卵黄囊内,每胚0.2ml,置37℃继续孵育,收集24~30小时内死亡的鸡胚卵黄液,经纯检合格后,作为一级种子液。置-20℃以下保存,保存期应不超过1个月。
2.1.2 二级种子繁殖 取收获的鸡胚卵黄液一级种子,分别划线接种含15μg/ml NADH和10%健康鸡血清的鸡肉汤琼脂平板,置5%CO2环境下,37℃培养16~24小时,挑选数个荧光性强的典型菌落接种于含15μg/ml NADH和5%健康鸡血清的副鸡禽杆菌合成培养基中,置37℃培养16~20小时,经纯检合格后,即为二级种子。在2~8℃保存,不得超过6~8小时。
2.2 制苗用培养基 为副鸡禽杆菌合成培养基,制造方法见附注2。
2.3 制苗菌液的制备 副鸡禽杆菌YT株和JN株的菌液分别制备。
2.3.1 菌液培养 采用微生物发酵罐培养副鸡禽杆菌菌液。将副鸡禽杆菌合成培养基装入发酵罐中,115℃灭菌40分钟,待培养基温度冷却至37℃左右时,加入终浓度15μg/ml NADH和2.5%健康鸡血清,按培养基总量的2%~3%接入副鸡禽杆菌二级种子液,混合均匀后,37℃培养12~16小时。
2.3.2 菌液检验
2.3.2.1 纯粹检验 取菌液接种TG小管2支,每支0.2ml,1支置35~37℃培养,1支置23~25℃培养,观察3~5日,应无菌生长;同时取菌液接种含15μg/ml NADH和5%健康鸡血清的鸡肉汤琼脂斜面小管2支,每支0.2ml,1支置35~37℃、5%CO2培养,1支置23~25℃、5%CO2培养,观察3~5日,应纯粹。
2.3.2.2 活菌计数 取样用鸡肉汤培养基按现行《中国兽药典》附录进行活菌计数,或用吸光度值法(见附注3)进行细菌计数,测得每ml菌液中含菌数均应≥2.0×109CFU。
2.3.3 菌液灭活与浓缩
2.3.3.1 菌液灭活 加入1%硫柳汞溶液,使其终浓度为0.01%,充分混合后,置2~8℃灭活7日,每日搅拌数次。灭活结束后,取样接种含15μg/ml NADH和10%健康鸡血清的鸡肉汤琼脂培养基平板,置37℃、5%CO2培养24小时,应无菌生长。
2.3.3.2 菌液浓缩 将灭活菌液用连续离心机离心浓缩(转速16000r/min,进料速度1000ml/min)或用0.22μm中空纤维过滤器进行浓缩,浓缩菌液用pH值7.2 0.01mol/L PBS重悬制备菌悬液,使最终菌悬液含菌数应≥6.0×109CFU/ml。
2.4 疫苗制备
2.4.1 水相制备 取灭活的副鸡禽杆菌YT株和JN株菌悬液,根据其含菌数与PBS液按一定比例混合,使最终每毫升疫苗中含灭活的副鸡禽杆菌YT株和JN株菌数均为2.0×109CFU。
2.4.2 佐剂制备 取商品化氢氧化铝胶佐剂转移到油相罐中,121℃灭菌1小时后备用。
2.4.3 疫苗配制 按照9︰1的比例将水相与铝胶佐剂混合,充分搅拌,再加入1%硫柳汞溶液,使其终浓度为0.01%,充分混合。
2.5 分装 定量分装,分装期间应随时搅拌,使其混合均匀,加塞密封,并粘贴标签。
3 成品检验
3.1 性状 静置后,上层为澄清液体,下层为灰白色沉淀,振摇后呈均匀混悬液。
3.2 装量检查 按现行《中国兽药典》附录进行检验,应符合规定。
3.3 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
3.4 安全检验 用4~5周龄的SPF鸡10只,各颈部皮下注射疫苗1.0ml,观察14日,应全部健活,且不出现因疫苗引起的局部和全身不良反应。
3.5 效力检验 用4~6周龄SPF鸡40只,其中20只各皮下注射疫苗0.5ml,另20只作对照,同条件饲养。接种后21日,取免疫鸡10只和对照鸡10只分别眶下窦内注射一个最小发病剂量的YT株强毒菌液(附注4)0.2ml;另取免疫鸡10只和对照鸡10只分别眶下窦内注射一个最小发病剂量的JN株强毒菌液(附注4)0.2ml。攻毒后观察7日。各对照组应至少8只发病(攻毒鸡出现面部一侧或两侧眶下窦及周围肿胀或流鼻涕任一症状即判为发病),各免疫组应至少8只保护。
3.6 汞类防腐剂残留量测定 按现行《中国兽药典》附录进行测定,应符合规定。
4 作用与用途 用于预防由A型和C型副鸡禽杆菌引起的鸡传染性鼻炎。一次免疫,免疫期为4个月,二次免疫,免疫期为9个月。
5 用法与用量 颈背部皮下注射。4周龄以上鸡,每只0.5ml;建议初免后3个月加强免疫1次,每只0.5ml。
6 注意事项
6.1 仅适用于接种健康鸡。
6.2 疫苗启封后,限当日用完。
6.3 切忌冻结,使用前应将疫苗温度恢复至室温,使用时应充分摇匀。
6.4 注射器具应严格消毒,接种时注射部位应进行局部消毒处理。
6.5 用过的疫苗瓶、注射器和未用完的疫苗等应进行无害化处理。
7 规格 (1)20ml/瓶 (2)100ml/瓶 (3)250ml/瓶 (4)500ml/瓶
8 贮藏与有效期 2~8℃保存,有效期为15个月。
附注:
1 副鸡禽杆菌血凝(HA)和血凝抑制(HI)试验方法
1.1 材料
1.1.1 材料 96孔V型微量血凝板、微量板振荡器、移液器、吸头;
1.1.2 血清 副鸡禽杆菌A型阳性血清(血凝抑制抗体效价≥1︰40)、副鸡禽杆菌C型阳性血清(血凝抑制抗体效价≥1︰40)、副鸡禽杆菌阴性血清(A型、C型血凝抑制抗体效价均<1︰5);
1.1.3 菌种 副鸡禽杆菌C-Apg-8株、副鸡禽杆菌Apg-668株、副鸡禽杆菌YT株、副鸡禽杆菌 JN株;
1.2 方法
1.2.1 抗原制备
将副鸡禽杆菌C-Apg-8株、Apg-668株、YT株、JN株分别接种含15μg/ml NADH和10%健康鸡血清的副鸡禽杆菌合成培养基琼脂平皿,置37℃、5%CO2环境下培养18~24小时。用PBS(pH值7.2,0.01mol/L)洗下菌苔,8000r/min离心10分钟,弃上清液,菌泥用PBS悬浮,然后8000r/min再离心10分钟,弃上清,菌泥用含0.01%硫柳汞的PBS悬浮,用吸光度值法(见附注3)进行细菌计数,稀释成每毫升菌液中含菌数≥1.0×1011CFU,置2~8℃灭活7日,即为副鸡禽杆菌血凝和血凝抑制试验用抗原。
1.2.2 血凝(HA)效价测定 在20℃~25℃室温环境下进行试验。
先将抗原用生理盐水进行5倍稀释(如100μl抗原+400μl生理盐水)。取洁净血凝板,第1孔加入5倍稀释的抗原60μl,第2孔至第12孔,每孔加入生理盐水30μl,从第1孔吸取30μl 5倍稀释的抗原加入第2孔,混匀后由第2孔取30μl移至第3孔,如此进行2倍系列稀释,至第11孔,由第11孔吸弃30μl,第12孔不加抗原,作红细胞对照,第1孔至第12孔每孔分别加入1%鸡醛化红细胞悬液30μl,充分振荡均匀后,室温静置30~60分钟(以红细胞对照孔中鸡醛化红细胞完全下沉为准),判定抗原的血凝(HA)效价,即为使红细胞发生完全凝集的抗原最大稀释倍数。
1.2.3 血凝抑制试验细菌分型鉴定 在20℃~25℃环境下进行试验。
1.2.3.1 对照血清预处理
用10%鸡醛化红细胞悬液对A型阳性血清、C型阳性血清、阴性血清进行5倍稀释,室温下作用4小时或2~8℃过夜,期间充分振荡数次,1500r/min离心10分钟,取上清液即为5倍稀释的血清。
1.2.3.2 血清稀释
取洁净血凝板,取预处理的A型阳性血清、C型阳性血清、阴性血清分别稀释2排、2排、4排。每排第1孔加入5倍稀释的相应对照血清60μl,第2孔至第11孔每孔加入生理盐水30μl,从第1孔取30μl 5倍稀释的血清加入第2孔,混匀后由第2孔吸取30μl 移至第3孔,如此做2倍系列稀释至第10孔,从第10孔弃去30μl 液体。第11孔不加血清,作为抗原凝集对照,第12孔加入生理盐水60μl,不加血清和抗原,作为红细胞对照。
1.2.3.3 4HA单位抗原配制
用生理盐水对副鸡禽杆菌A型C-Apg-8株、C型Apg-668株、YT株和JN株待检抗原分别进行稀释,配成4HA单位的抗原(如血凝效价为1︰160,则抗原稀释至40倍)。
1.2.3.4 血凝抑制(HI)试验
在稀释后的A型阳性血清第1排的第1孔至第11孔每孔加入4HA单位的副鸡禽杆菌YT株抗原30μl,其第2排的第1孔至第11孔每孔加入4HA单位的副鸡禽杆菌A型C-Apg-8株对照抗原30μl,作为阳性对照;
在稀释后的阴性血清第1排的第1孔至第11孔每孔加入4HA单位的副鸡禽杆菌YT株抗原30μl,其第2排的第1孔至第11孔每孔加入4HA单位的副鸡禽杆菌A型C-Apg-8株对照抗原30μl,作为阴性对照;
在稀释后的C型阳性血清第1排的第1孔至第11孔每孔加入4HA单位的副鸡禽杆菌JN株抗原30μl,其第2排的第1孔至第11孔每孔加入4HA单位的副鸡禽杆菌C型Apg-668株对照抗原30μl,作为阳性对照;
在稀释后的阴性血清第3排的第1孔至第11孔每孔加入4HA单位的副鸡禽杆菌JN株抗原30μl,其第4排的第1孔至第11孔每孔加入4HA单位的副鸡禽杆菌C型Apg-668株对照抗原30μl,作为阴性对照;
充分振荡,置室温作用30~60分钟,所有孔分别加入1%鸡醛化红细胞悬液30μl,充分振荡,置室温作用30~60分钟(以红细胞对照孔中鸡醛化红细胞完全下沉为准),以使鸡醛化红细胞凝集被完全抑制的血清最高稀释度作为判定终点,记录血清血凝抑制抗体效价。
1.3 结果判断
1.3.1 试验成立的条件
1.3.1.1 阳性对照
副鸡禽杆菌A型C-Apg-8株抗原与A型阳性血清反应,HI效价应≥1︰40,副鸡禽杆菌C型Apg-668株抗原与C型阳性血清反应,HI效价应≥1︰40。
1.3.1.2 阴性对照
副鸡禽杆菌A型C-Apg-8株抗原与阴性血清反应,HI效价应<1︰5,副鸡禽杆菌C型Apg-668株抗原与阴性血清反应,HI效价应<1︰5。
1.3.2 判定
当副鸡禽杆菌YT株待检抗原与A型阳性血清反应,HI效价≥1︰40,同时与阴性血清反应,HI效价<1︰5时,则判定副鸡禽杆菌YT株的血清型为A型。
当副鸡禽杆菌 JN株待检抗原与C型阳性血清反应,HI效价≥1︰40,同时与阴性血清反应,HI效价<1︰5时,则判定副鸡禽杆菌JN株的血清型为C型。
2 培养基制备
2.1 鸡肉汁
取鸡胸脯肉泥1份加蒸馏水2份,置2~8℃浸泡过夜,煮沸30分钟,除去肉渣,澄清过滤。
2.2 鸡肉汤培养基
鸡肉汁100ml
酪蛋白胨 1g
氯化钠 0.5g
调pH值至7.2,115℃灭菌30分钟,用前加入过滤除菌的新鲜酵母浸出液20ml、健康鸡血清5ml和终浓度为15μg/ml的NADH(辅酶I)溶液。
2.3 鸡肉汤琼脂
在鸡肉汤中加入1.5%琼脂粉热溶即成。但要在倒平板前(50~60℃时)加入终浓度为15μg/ml的NADH(辅酶I)溶液和10%的健康鸡血清。
2.4 副鸡禽杆菌合成培养基
胰蛋白胨5.6g
大豆蛋白胨 11.2g
酵母浸粉11.2g
氯化钠 11.2g
L-谷氨酸钠 8.96g
葡萄糖 4.48g
蒸馏水 2000ml
以氢氧化钠溶液(2mol/L)调pH值至7.2~7.4,115℃灭菌40分钟。临用前加入终浓度为15μg/ml的NADH(辅酶I)溶液和2.5%的健康鸡血清。
3 吸光度值法测定细菌数
取副鸡禽杆菌菌液,8000r/min离心10分钟,弃上清液,菌泥用pH值7.2 0.01mol/L PBS重悬制备菌悬液,恢复至原体积,用PBS作为空白对照,用分光光度计测定OD600nm值。
当OD600nm值在0.2~1.2之间时有效,若超出该范围则应进行适当的稀释或浓缩。测得的OD600nm值作为X代入回归方程:Y=19.984X-1.405,计算得的Y值即为菌悬液的菌数。
4 攻毒菌液1个最小发病量的测定和制备方法
4.1 攻毒菌种的制备
取副鸡禽杆菌YT株或JN株菌种分别划线接种含15μg/ml NADH和10%健康鸡血清的鸡肉汤琼脂平板,置5% CO2环境下37℃培养16~24小时,挑选数个荧光性强的典型菌落,接种于含15μg/ml NADH和5%健康鸡血清的鸡肉汤液体培养基,37℃培养24小时,分别接种于5~6日龄SPF鸡胚卵黄囊内,每胚0.2ml,置37℃继续孵育,收集24~30小时内死亡的鸡胚卵黄液,2ml/瓶分装冻干,经纯检合格后,置-40℃以下保存。保存期不超过12个月。
4.2 1个最小发病量的测定
取-40℃保存的冻干菌种1瓶,采用鸡肉汤琼脂培养基(附注2),按现行《中国兽药典》附录进行活菌计数,然后再取相同批次相同保存条件的另1支菌种用鸡肉汤培养基稀释成不同的稀释度(1.0×103CFU、5.0×103CFU、2.5×104CFU、1.25×105CFU/ml),每个稀释度各眶下窦注射7~9周龄SPF鸡10只,每只0.2ml,每日观察记录鸡的发病情况,观察7日。当试验鸡出现面部一侧或两侧眶下窦及周围肿胀或流鼻涕任一症状即判为发病,能使8只试验鸡发病的最小攻毒剂量就定为最小发病剂量。
4.3 1个最小发病量攻毒菌液的制备方法
攻毒前取相同批次相同保存条件的冻干菌种用鸡肉汤培养基稀释至相应最小发病剂量的菌液浓度,即为攻毒菌液。
二、非洲猪瘟病毒荧光等温扩增检测试剂盒制造及检验试行规程
本品系用非洲猪瘟病毒 VP72 基因设计合成的三对特异性引物组成的荧光等温扩增反应液,以携带非洲猪瘟病毒 VP72 基因的质粒 pMD20-T-VP72 为阳性对照,以 DEPC 处理水为阴性对照,以 Bst DNA 聚合酶及矿物油等组分组装而成,用于血液、血球粉、淋巴结、脾脏、扁桃体、肌肉中的非洲猪瘟病毒核酸的检测。
1 荧光等温扩增反应液的制备与检验
1.1 荧光等温扩增反应液的制备
用于本试剂盒的荧光等温扩增反应液是由 10×等温扩增缓冲液、引物液、甜菜碱、dNTP Mixture、MgSO4 溶液、SYBR Green I、DEPC 水等按照一定的比例配制而成。
1.1.1 10×等温扩增缓冲液的配制 称取 Tris base:24.23g,KCl:3.73g,(NH4)2SO4:6.607g,
MgSO4.7H2O:2.465g,Triton X-100:5ml,Brij-58:5ml,加 DEPC 处理水至 400ml,用盐酸调 pH 值至 8.8(25℃),定容至 500ml。高压灭菌冷却后放在 2~8℃保存备用。
1.1.2 引物液的配制
1.1.2.1 引物合成
按照下表合成引物,由华大基因合成,合成20OD 以上,HPLC 分析,得到单吸收峰图谱;用紫外分光光度计测定 OD260 nm/OD280nm 的比值应在 1.6~2.0 之间。
ASFB3 GTAGACGCAATATACGCTTTA
ASFF3 GCCATTTAAGAGCAGACATT
ASFBIP GTGTATTTCAGGGGTTACAAACAGGTTTTGGAGTCATTAATGAAATCTCGC
ASFFIP GTAAAACGCGTTCGATTTTCCCTTTTGTGGTGGTTATTGTTGGTGT
ASFLB GATGTAAAGTTCATTATTCGTG
ASFLF TGATACGTGTCCATA
1.1.2.2 引物液配制 将引物 ASFF3、ASFB3、ASFFIP、ASFBIP 用 DEPC 处理水稀释至20μmol/L , 将 引 物 ASFLF 、 ASFLB 用 DEPC 处 理 水 稀 释 至 40μmol/L , 按ASFF3︰ASFB3︰ASFFIP︰ASFBIP︰ASFLF︰ASFLB=0.25︰0.25︰2︰2︰0.5︰0.5 的比例将稀释后的引物混合。
1.1.3 100 mmol/L MgSO4 的配制 称取 MgSO4.7H2O:2.467g,加 DEPC处理水定容至100ml,高压灭菌冷却后放在 2~8℃保存备用。
1.1.4 5 mol/L 甜菜碱溶液的配制 称取 58.575g 甜菜碱,加 DEPC处理水定容至 100ml。
1.1.5 10 mmol/L dNTP Mixture 来源系外购商品(如TaKaRa公司);10mmol/L 的 dNTP Mixture 中的 dATP、dCTP、dGTP和 dTTP 纯度均>98%。
1.1.6 SYBR Green I 液的配制 来源系外购商品(如sigma公司),用 DEPC处理水 1︰1000 稀释。
1.1.7 DEPC 处理水的配制 量取 1ml 的 DEPC,加入至1L的双蒸水,其终浓度为 0.1%,室温搅拌处理 12 小时,高压(121℃)蒸汽灭菌15分钟,冷却后4℃保存备用。
1.1.8 荧光等温扩增反应液的制备 取 10×等温扩增缓冲液、引物液、5mol/L 甜菜碱溶液、10 mmol/L dNTP Mixture、100mmol/L MgSO4溶液、SYBR Green I液、DEPC 处理水按表1配方,配制一定量的荧光等温扩增反应液(全程无菌低温)。过滤(0.45μm)除菌后,无菌定量分装,加贴标签。
表 1 荧光等温扩增反应液配方
|
成分 |
体积比例(1 个反应 22μl) |
|
10×等温扩增缓冲液 |
2.5 μl |
|
引物液 |
5.5 μl |
|
5 mol/L 甜菜碱溶液 |
4 μl |
|
10mmol/L dNTP Mixture |
3.5 μl |
|
100 mmol/L MgSO4 溶液 |
1.5μl |
|
SYBR Green I 液 |
0.5μl |
|
DEPC 处理水 |
4.5 μl |
1.2 荧光等温扩增反应液的检验
1.2.1 性状 为无色透明澄清液体。
1.2.2 无菌检验 按照现行《中国兽药典》附录进行检验,应无菌生长。
1.2.3 规格 1100μl/管
1.2.4 贮藏与有效期 -20℃保存,有效期为12个月。
2 Bst DNA 聚合酶的制备和检验
2.1 Bst DNA 聚合酶的制备
2.1.1 Bst DNA 聚合酶 系外购商品(如NEB 公司),8U/μl,1000μl/管。
2.1.2 配制 将 Bst DNA 聚合酶无菌定量分装,加贴标签。
2.2 Bst DNA 聚合酶的检验
2.2.1 性状 无色透明粘稠液体。
2.2.2 规格 50μl/管
2.2.3 贮藏与有效期 -20℃保存,有效期为 12个月。
3 矿物油的制备及检验
3.1 矿物油的制备
3.1.1 矿物油 系液体石蜡油,北京化学试剂公司产品。
3.1.2 配制 将液体石蜡油定量分装,加贴标签。
3.2 矿物油检验
3.2.1 性状 无色透明粘稠液体。
3.2.2 规格 1000μl/管。
3.2.3 贮藏与有效期 -20℃保存,有效期为12个月。
4 阴性对照的制备及检验
4.1 阴性对照的制备 量取1ml 的 DEPC,加入至 1L 的双蒸水,其终浓度为 0.1%,室温搅拌处理 12 小时,高压(121℃)蒸汽灭菌 15 分钟,冷却后进行无菌分装,加贴标签。
4.2 阴性对照的检验
4.2.1 性状 无色透明液体。
4.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
4.2.3 规格 1000μl/管
4.2.4 贮藏与有效期 -20℃保存,有效期为12个月。
5 阳性对照的制备及检验
5.1 阳性对照的制备
5.1.1 制备阳性对照用携带重组质粒的克隆菌株Top10菌种。
5.1.1.1 菌种的来源 制备阳性对照用携带重组质粒的克隆菌株 Top10 菌种由北京森康生物技术开发有限公司制备、鉴定、保管和供应。
5.1.1.2 菌种标准
(1) 形态与染色 短杆菌,大小 0.5×1~3μm,单个散在,革兰氏染色阴性。
(2) 培养特性 在含有氨苄抗性的LB固体培养基生长良好。用上述培养基平板划线,置 37℃培养 12~16小时,菌落为白色、边缘整齐、表面光滑、半透明。
(3) 纯粹检验 按现行《中国兽药典》附录进行检验,应纯粹。
(4) PCR 检验 合成扩增非洲猪瘟病毒 VP72 基因的两条引物,分别使用 DEPC 处理水将其稀释为 10μmol/L 的工作浓度。
VP72F:5’- ATGGCATCAGGAGGAGCTT -3’
VP72R:5’- TTAGGTACTGTAACGCAGCACAG -3’
PCR 反应体系:25μl 的反应体系中,含有 2.5μl 10×PCR 缓冲液,2μl 2.5mmol/L 的dNTPs,10μmol/L 的上下游引物 VP72F、VP72R 各 0.5μl,5 U/μl Taq 酶 0.5μl,菌液 1μl。
PCR 反应程序:94℃/5 分钟;94℃/30 秒,54℃/30 秒,72℃/1 分钟,30个循环;最后 72℃延伸10分钟。
PCR 扩增结果:扩增产物用 1.0%琼脂糖凝胶进行电泳鉴定,应出现一条特异性 PCR 条带,大小为 1941kb。
(5) 序列测定 提取携带重组质粒的 Top10 菌株的质粒,送测序公司进行序列测定,测得序列应与原非洲猪瘟病毒株 VP72 基因序列一致。
(6) 基础菌种代次 1~10 代。
(7) 菌种的保存 -80℃保存,有效期24个月。
5.1.2 阳性对照生产种子的制备 将检定合格的-80℃保存的携带重组质粒的克隆菌株 Top10 接种含有氨苄抗性的 LB 固体培养基,37℃培养 12~16 小时,观察菌落形态,选取白色菌落10个,移植于相同抗性的 LB 固体斜面培养基,37℃培养 12~16 小时,作为生产用种子。2~8℃保存,使用期不超过1个月。
5.1.3 阳性对照用菌液的制备 将鉴定合格的携带重组质粒的克隆菌株 Top10 生产用种子接种 3~5 ml液体LB培养基,37℃摇床振荡培养12~16小时,PCR检验合格后,用于质粒提取。
5.1.4 重组质粒的提取 使用商品化质粒提取试剂盒(例如TaKaRa 公司)从 5.1.3 制备的菌液中提取重组质粒,用 1.0%琼脂糖凝胶电泳的方法对提纯的质粒进行纯度检测,用 Nanodrop2000 测定重组质粒的含量。
5.1.5 检验 取制备质粒用 NanoDrop 2000 测定其 260nm和 280nm 的吸光度值(OD260和OD280),OD260nm/OD280nm 的比值应在1.8~2.0之间。
5.1.6 拷贝数的计算 根据 5.1.5 测定的OD260和OD280,计算质量浓度:
质量浓度(μg/μl)= OD260×50×稀释倍数/1000。
同时根据测序结果,利用 DNAMAN(Version 6)计算出双链模板的分子量。根据上述计算的浓度和分子量,根据以下公式计算出每微升体积中 DNA 的拷贝数。
拷贝数(copies/μl)=(6.022×1023 copies / mol)×(质量浓度μg/μl) /106 (MW g/mol)。
5.1.7 阳性对照制备 将上述质粒用 TE 缓冲液稀释至 104 拷贝数/μl,按照200μl/管的规格进行无菌定量分装,加贴标签。
5.2 阳性对照的检验
5.2.1 性状 无色透明液体。
5.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
5.2.3 规格 200μl/管
5.2.4 贮藏与有效期 -20℃保存,有效期为12个月。
6 试剂盒的组装
将荧光等温扩增反应液、Bst DNA 聚合酶、矿物油、阴性对照及阳性对照按表 2 要求量用外包装盒包装,贴签(标识名称、批号、生产日期、有效期和生产单位信息等)。
表 2 非洲猪瘟病毒荧光等温扩增检测试剂盒组成清单
|
组 份 |
规 格 |
|
荧光等温扩增反应液 |
1100 μl/管 x1 管 |
|
Bst DNA 聚合酶 |
50 μl/管 x1 管 |
|
阴性对照 |
1000 μl/管 x1 管 |
|
阳性对照 |
200 μl/管 x1 管 |
|
矿物油 |
1000 μl/管 x1 管 |
|
说明书 |
1 份/盒 |
7 成品检验
7.1 性状 试剂盒的外包装应无破损,印刷文字和图案正确;产品批号、保存条件和有效期标示正确无误。内包装应无破损、无裂痕、无渗漏,品名、批号、保存条件、有效期等清晰。其中:
(1) 荧光等温扩增反应液 无色透明澄清液体,装量为 1100μl/管,共 1 管。
(2) Bst DNA 聚合酶 无色透明粘稠液体,装量为 50μl/管,共 1 管。
(3) 阴性对照 无色透明液体,装量为 1000 μl/管,共 1 管。
(4) 阳性对照 无色透明液体,装量为 200 μl/管,共 1 管。
(5) 矿物油 无色透明粘稠液体,装量为 1000 μl/管,共 1 管。
7.2 无菌检验 按现行《中国兽药典》附录进行无菌检验,荧光等温扩增反应液、阴性对照及阳性对照均应无菌生长。
7.3 敏感性检验 将敏感性质控品用 DEPC 处理水作 1︰10、1︰100、1︰1000、1︰10000、1︰100000 稀释(附注 1),按照试剂盒“用法与判定”进行检测和判定,1︰1000 以内稀释时结果应为阳性,1︰10000 稀释可为阳性或阴性,1︰100000 稀释应为阴性。
7.4 特异性检验 按照试剂盒“用法与判定”对特异性质控样品 T1、T2、T3、T4、T5、T6、T7、T8(见附注 2)进行检测和判定,T1、T2、T3、T4、T5、T6、T7、T8 的结果应为阴性。
8 作用与用途 用于血液、血球粉、淋巴结、脾脏、扁桃体、肌肉中非洲猪瘟病毒核酸的检测。
9 用法与判定
9.1 用法
9.1.1 样品处理 血液样品:用双蒸水作 1︰5 稀释后备用;淋巴结、脾脏、扁桃体、肌肉样品,用无菌的剪刀和镊子剪取待检样品 2.0 g 于研钵中充分研磨,再加 10.0 ml PBS(pH 7.2,含1万单位青霉素和1万单位链霉素)混匀(样品不足2.0 g 按1︰5 比例加 PBS),3000 r/min,4 ℃离心5分钟,取上清液,编号备用;血球粉处理同上,只不过省掉研磨步骤。
9.1.2 样品存放采集或处理好的样品在 2℃~8℃条件下保存最好不超过 24 小时;若需长期保存,须放置-80℃冰箱,但应避免反复冻融。
9.1.3 操作步骤
(1)反应预混液的配制 按照下表配制反应预混液(注:配制和分装反应预混液时应在冰盒上进行)。按照n+2 管配制(n = 样品数)。
表3 反应预混液的配制
|
序号 |
组份 |
1头份样品的量(μl) |
(n+2)头份样品的量(μl) |
|
1 |
荧光等温扩增反应液 |
22 |
22×(n+2) |
|
2 |
Bst DNA聚合酶 |
1.0 |
1.0 ×(n+2) |
(2)反应预混液分装 取n+2 个 0.2ml PCR管,将配制的反应预混液涡旋混匀,瞬时离心后,按每管 23μl分装于PCR管内。
(3)每管加入20 μl矿物油。
(4)加样 向对应的PCR管底部加入上述处理的样品 2.0μl。同时,向阳性对照管内加入2.0μl 阳性对照,向阴性对照管内加入2.0μl DEPC水。盖紧管盖,瞬时离心,转移至检测区。
(5)检测 将离心后的PCR管放入检测仪内(专用配套仪器或普通的荧光 PCR 仪均可),设定好被检样品(S)、阳性对照(PC)、阴性对照(NC)的位置。反应参数设置:采用 64℃60分钟,每1分钟 采集一次FAM通道荧光信号,共采集 60 次。
9.2 判定
9.2.1 结果分析条件的设定 阈值设定原则:根据仪器噪声情况进行调整,以阈值线刚好超过阴性对照品扩增曲线的最高点为准。
9.2.2 质控标准
9.2.2.1 阴性对照无Tt值(Time Threshold)并且无扩增曲线即 S 型扩增曲线。
9.2.2.2 阳性对照的Tt值应小于或等于 45,并出现典型的扩增曲线。
9.2.2.3 如阴性和阳性对照不满足以上条件,此次实验视为无效。
9.2.3 结果判定
9.2.3.1 阴性:无Tt值,且无特征性扩增曲线,表明样品为阴性。
9.2.3.2 阳性:Tt值≤45,且出现典型的扩增曲线,表示样品为阳性。
9.2.3.3 Tt 值>45,且出现典型的扩增曲线的样品建议复验,复验仍出现上述结果的,判为阳性,否则判为阴性。
9.2.3.4 出现Tt值但无特征性扩增曲线的样品,判定为阴性。
10 注意事项
10.1 实验前请仔细阅读本试剂盒说明书,请严格按照操作步骤进行检测。反应液在使用前要彻底融化。分装反应液时,应尽量避免产生气泡。上机前注意检查各反应管是否盖紧,以免交叉污染。阳性对照在吸取前应瞬时离心后使用。
10.2 本试剂盒需-20℃保存,并在有效期内使用。试剂盒中各组分应避免反复冻融。
10.3 鉴于ASFV为一类检疫性疫病,上述操作应在相关生物安全设施内进行。对样品及其废弃物的操作应严格遵守生物安全规定。
10.4 扩增完的PCR管切勿打开,以防污染。
10.5 本试剂盒仅供兽医诊断使用。
11 规格 48 检测/盒
12 贮藏与有效期 -20℃保存,有效期为 12 个月。
附注
1 敏感性质控样品的制备和检验 由于质粒 DNA 在浓度较稀时不稳定,容易降解,本试剂盒的敏感性检验质控品由含量为104 拷贝/μl 的质粒 DNA 组成,用 DEPC 处理水作 1︰10、1︰100、1︰1000、1︰10000、1︰100000稀释,敏感性质控样品应现稀释现用。
1.1 制备 将质粒DNA用TE 缓冲液稀释至 104 拷贝数/μl,分装成200 μl/管,-80℃保存。
1.2 检验
1.2.1 性状 无色透明液体。
1.2.2 试剂盒检验 将敏感性质控样品用DEPC处理水作 1︰10、1︰100、1︰1000、1︰10000、
1︰100000 稀释,按“用法与评定”检测,1︰1000 稀释以内结果应为阳性,1︰10000 稀释时结果可为阳性或阴性,1︰100000稀释时结果应为阴性。
1.2.3 贮藏与有效期 -80℃保存,有效期为 24个月。
2 特异性质控样品(T1~T8)的制备和检验
2.1 制备 采集正常猪肝脏、血液、淋巴结、肌肉、脾脏,血液用 PBS 作1︰10稀释;肝脏、淋巴结、肌肉、脾脏样品,用无菌的剪刀剪碎,于研钵中充分研磨,按照每1.0g样品加10.0 ml PBS(pH 7.2,含1万单位青霉素和1万单位链霉素)的比例混匀,3000rpm 离心10分钟,上清0.45μm滤膜过滤除菌,分装成 300μl/管,命名:肝脏T1、血液T2,淋巴结T6,肌肉T7,脾脏T8;提取伪狂犬病活疫苗、猪细小病毒细胞培养液、猪圆环病毒2型细胞培养液的核酸,分别TE缓冲液作 1︰1000 倍稀释,0.45μm 滤膜过滤除菌,分装成 300μl/管,依次命名为 T3、T4、T5,T1~T8 用于特异性检验质控品,-80℃保存。
2.2 检验
2.2.1 性状 T1、T2、T8 为红褐色液体,T6、T7 为褐色或白色液体,T3、T4、T5 为无色透明液体。
2.2.2 试剂盒测定 用检测合格的非洲猪瘟病毒荧光等温扩增检测试剂盒检验,T1、T2、T3、T4、T5、T6、T7、T8结果应为阴性。用伪狂犬病毒实时荧光 PCR 检测方法检测,T3 应为阳性。用猪细小病毒实时荧光 PCR 检测方法检测,T4 应为阳性。用猪圆环病毒2型实时荧光 PCR 检测方法检测,T5应为阳性。
2.3 贮藏与有效期 -80℃保存,有效期24 个月。
3 TE 缓冲液的配制 1mol/L pH 值 8.0 Tris-HCl 缓冲液 10ml,加入 2ml 500mmol/L pH 值8.0的EDTA,用去离子水定容至1000ml,121±2℃高压灭菌15分钟。
三、非洲猪瘟病毒荧光PCR检测试剂盒制造及检验试行规程
本试剂盒系由消化液、DNA结合液、DNA洗涤液、DNA洗脱液、蛋白酶K、无菌无核酸酶水、PCR扩增反应液、实时荧光混合液、阳性对照、阴性对照、DNA吸附柱和收集管组装而成。用于猪全血、血清、脾脏、淋巴结、肌肉等组织样品及粪便样品中非洲猪瘟病毒DNA的检测。
1 菌种
1.1 制造本品用菌种为重组大肠埃希氏菌DH5α/pMD19-T-ASFV II-p72株,由北京世纪元亨动物防疫技术有限公司鉴定、保管和供应。
1.2 菌种标准
1.2.1 培养特性 取菌种划线接种于含氨苄青霉素的LB琼脂平板(附注1)上,37℃培养16小时,应形成大小为1~2mm的白色菌落,表面光滑。
1.2.2 纯粹 按现行《中国兽药典》附录进行检验,应纯粹。
1.2.3 特异性 取1ml菌种,用商品化的质粒提取试剂盒提取质粒,用EcoRI和SalI进行双酶切后,进行电泳,应出现大小约为1.9kb的核酸片段,且测序结果与目的序列相符。
1.2.4 基础种子代数 F2~F4代。
1.2.5 菌种保存 -70℃以下保存,保存期为12个月。
2 试剂盒各组分制备和检验
2.1 消化液制备和检验
2.1.1 制备 8mol/L盐酸胍500ml,吐温20 10ml,曲拉通X100 1ml,0.5mol/L EDTA·2Na(pH值8.0)2ml,CaCl2 1ml,用纯化水定容至1L,定量分装,每瓶11ml。
2.1.2 检验
2.1.2.1 性状 淡黄色澄清液体。
2.1.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.1.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.1.2.4 贮藏与有效期 室温保存,有效期为24个月。
2.2 DNA结合液制备和检验
2.2.1 制备 2mol/L Tris(pH值7.4)10ml, 1mol/L CaCl2 10ml,无水乙醇800ml,用纯化水定容至1L,定量分装,每瓶11ml。
2.2.2 检验
2.2.2.1 性状 无色澄清液体。
2.2.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.2.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.2.2.4 贮藏与有效期 室温保存,有效期为24个月。
2.3 DNA洗涤液制备和检验
2.3.1 制备 2mol/L Tris(pH值7.4)10ml, 5mol/L NaCl 20ml,无水乙醇 800ml,用纯化水定容至1L,定量分装,每瓶52ml。
2.3.2 检验
2.3.2.1 性状 无色澄清液体。
2.3.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.3.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.3.2.4 贮藏与有效期 室温保存,有效期为24个月。
2.4 DNA洗脱液制备和检验
2.4.1 制备 2mol/L Tris(pH值7.4) 10ml, 0.5mol/L EDTA·2Na 1ml, HCl 1ml, NaN3 4ml,用纯化水定容至1L,定量分装,每瓶4ml。
2.4.2 检验
2.4.2.1 性状 无色澄清液体。
2.4.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.4.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.4.2.4 贮藏与有效期 室温保存,有效期为24个月。
2.5 蛋白酶K制备和检验
2.5.1 制备 购买商品化蛋白酶K(干粉),将蛋白酶K(干粉)用无菌无核酸酶水溶解至浓度为20mg/ml,定量分装,每管1.1ml。
2.5.2 检验
2.5.2.1 性状 无色澄清液体。
2.5.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.5.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.5.2.4 贮藏与有效期 -20℃以下保存,有效期为18个月。
2.6 无菌无核酸酶水制备和检验
2.6.1 制备 购买商品化试剂,试剂瓶外观应无破损,密闭良好,无液体外溢,定量分装,每管600ml。
2.6.2 检验
2.6.2.1 性状 无色澄清液体。
2.6.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.6.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.6.2.4 贮藏与有效期 2~8℃保存,有效期为24个月。
2.7 PCR扩增反应液制备和检验
2.7.1 制备 购买商品化试剂,试剂瓶外观应无破损,密闭良好,无液体外溢。PCR扩增反应液含有Taq DNA热启动酶、dNTPs、MgCl2等成分,定量分装,每管600ml。
2.7.2 检验
2.7.2.1 性状 无色澄清液体。
2.7.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.7.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.7.2.4 贮藏与有效期 -20℃以下保存,有效期为24个月。
2.8 实时荧光混合液制备和检验
2.8.1 制备
2.8.1.1 引物制备和检验
2.8.1.1.1 引物制备 上游引物ASF-F7,序列为5'-TAGCAGATGCCGATACCACAAG-3';下游引物ASF-R7,序列为5'-GAGGAATACCAACCCAGTGGTC-3',由试剂公司合成。试剂瓶外观应无破损,密闭良好,未溶解的引物应为无色透明沉淀,贴附于管底。分别用无菌无核酸酶水将上、下游引物溶解至贮存浓度100pmol/ml,再用无菌无核酸酶水将上、下游引物稀释至工作浓度10pmol/μl,置-20℃以下保存。
2.8.1.1.2 引物检验
2.8.1.1.2.1 性状 无色澄清液体,无沉淀。
2.8.1.1.2.2 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.8.1.1.2.3 贮藏与有效期 -20℃以下保存,有效期为18个月。
2.8.1.2 探针制备和检验
2.8.1.2.1 探针制备 探针ASF-P4,序列为5'-[FAM]-ACG+TAATC+CG+TGTCCC- [BHQ1]-3'-LNA(5',3'端分别标记荧光报告基团和荧光淬灭基团),由试剂公司合成。试剂瓶外观应无破损,密闭良好,棕管避光保存,试剂为干粉。将探针ASF-P4用无菌无核酸酶水溶解至贮存浓度100pmol/ml,再用无菌无核酸酶水将探针ASF-P4稀释至工作浓度10pmol/μl,-20℃以下保存。
2.8.1.2.2 探针检验
2.8.1.2.2.1 性状 棕色液体,无沉淀。
2.8.1.2.2.2 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.8.1.2.2.3 贮藏与有效期 -20℃以下保存,有效期为18个月。
2.8.1.3 ROX染料制备和检验
2.8.1.3.1 ROX染料制备 购买商品化试剂,试剂瓶外观应无破损,密闭良好,无液体外溢。
2.8.1.3.2 ROX染料检验
2.8.1.3.2.1 性状 淡棕色液体,无沉淀。
2.8.1.3.2.2 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.8.1.3.2.3 贮藏与有效期 -20℃以下保存,有效期为24个月。
2.8.1.4 实时荧光混合液制备 将10pmol/ml的上游引物、10pmol/ml的下游引物、10pmol/μl的探针和ROX染料以10∶10∶5∶1的比例,混匀制成实时荧光混合液,定量分装,每管155ml。
2.8.2 检验
2.8.2.1 性状 淡棕色液体,无沉淀。
2.8.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.8.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.8.2.4 贮藏与有效期 -20℃以下保存,有效期为12个月。
2.9 阳性对照制备和检验
2.9.1 生产用菌种制备
2.9.1.1 划线 将菌种划线接种于含氨苄青霉素的LB琼脂平板(附注1)上,37℃培养过夜。
2.9.1.2 挑菌 挑取符合1.2.1项的单个菌落,接种于4ml含氨苄青霉素的LB培养基(附注1)中,37℃ 220r/min振荡培养8小时。
2.9.1.3 扩大培养 取过夜培养的新鲜菌液,按0.8%(ml/ml)的比例接种于含氨苄青霉素的LB培养基(附注1)中,37℃ 220r/min振荡培养12~16小时。
2.9.1.4 收获及分装 将收获的菌液与50%无菌甘油按1∶1(v/v)的比例混合均匀,定量分装,每管1ml。
2.9.1.5 菌种鉴定 按1.2.1、1.2.2和1.2.3项进行,应符合规定。
2.9.1.6 菌种保存 -70℃以下保存,应不超过12个月。
2.9.1.7 菌种继代 应不超过3代。
2.9.2 阳性对照制备
2.9.2.1 质粒制备
2.9.2.1.1 培养 将生产用菌种按0.8%(ml/ml)的比例接种于含氨苄青霉素的LB培养基(附注1)中,37℃ 220r/min振荡培养12~16小时。
2.9.2.1.2 离心收集菌体 以12000g离心1分钟,收集菌体沉淀。
2.9.2.1.3 质粒提取 用商品化的质粒提取试剂盒按说明书提取质粒。
2.9.2.1.4 酶切和纯化 将提取的质粒采用EcoRI限制性内切酶37℃消化1小时,72℃灭活15分钟,采用胶回收试剂盒再次纯化,即为线性化非洲猪瘟病毒阳性质粒,置-20℃以下保存。
2.9.2.2 质粒检验
2.9.2.2.1 性状 无色澄清液体,无沉淀。
2.9.2.2.2 浓度测定 用紫外分光光度计检测,质粒浓度应不低于30μg/ml,且不高于60μg/ml。
2.9.2.2.3 纯度测定 0.8%琼脂糖凝胶电泳,只应在4.6kb处出现一条核酸带。
2.9.2.2.4 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阳性。
2.9.2.3 稀释和分装 将线性化的非洲猪瘟病毒阳性质粒与消化液以1∶100000的比例混匀制成阳性对照,定量分装,每管600ml。
2.9.3 阳性对照检验
2.9.3.1 性状 淡黄色澄清液体。
2.9.3.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.9.3.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阳性。
2.9.3.4 贮藏与有效期 -20℃以下保存,有效期为12个月。
2.10 阴性对照制备和检验
2.10.1 制备
2.10.1.1 健康猪脾脏和淋巴结组织研磨液制备 按质量比1∶1取健康猪(2~4月龄,经OIE推荐的非洲猪瘟病毒实时荧光PCR方法检测为阴性)的脾脏和淋巴结组织,用手术剪剪碎混匀后于研磨器中研磨,按照质量体积比1∶30加入生理盐水继续研磨,待匀浆后转至灭菌离心管中,8000r/min离心2分钟,取上清液,用0.2mm滤芯过滤,定量分装,每管5ml。
2.10.1.2 健康猪脾脏和淋巴结组织研磨液检验
2.10.1.2.1 性状 淡黄色液体,有少量沉淀。
2.10.1.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.10.1.2.3 特异性检验 按OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)、国标GB/T 27540-2011《猪瘟病毒实时荧光RT-PCR检测方法》中实时荧光RT-PCR方法、国标GB/T18090-2008《猪繁殖与呼吸综合诊断方法》中RT-PCR方法、国标GB/T18641-2002《伪狂犬病诊断技术》中PCR方法和国标GB/T21674-2008《猪圆环病毒聚合酶链反应试验方法》中PCR方法分别进行检验,应均为阴性。
2.10.1.2.4 贮藏与有效期 -70℃以下保存,有效期为12个月。
2.10.1.3 稀释和分装 将健康猪脾脏和淋巴结组织研磨液与消化液以1∶1的比例混匀制成阴性对照,定量分装,每管600ml。
2.10.2 检验
2.10.2.1 性状 淡黄色液体,有少量沉淀。
2.10.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.10.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.10.2.4 贮藏与有效期 -20℃以下保存,有效期为12个月。
2.11 DNA吸附柱和收集管制备和检验
2.11.1 制备 购买商品化产品。吸附柱的装量为800μl/个,其离心柱层析膜材质为硅基质膜,厚度为0.28cm;收集管的装量为2ml/个。
2.11.2 检验
2.11.2.1 性状 外观透亮、完整、无破损,离心柱层析膜乳白色无杂质。
2.11.2.2 装量检验 取10个吸附柱,底部用封口膜封住,用移液器吸取800μl水,加入吸附柱中,达到吸附柱顶部,如无溢出判定为合格;另取10个收集管,用移液器吸取2ml水,加入收集管中,达到收集管顶部,如无溢出判定为合格。
2.11.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法(附注2)进行检验,应为阴性。
2.11.2.4 贮藏与有效期 室温保存,有效期为24个月。
3 试剂盒的组装 按照以下组分组装试剂盒。
|
组分 |
50份 |
|
|
装量 |
数量 |
|
|
消化液 |
11ml/瓶 |
1瓶 |
|
DNA结合液 |
11ml/瓶 |
1瓶 |
|
DNA洗涤液 |
52ml/瓶 |
1瓶 |
|
DNA洗脱液 |
4ml/瓶 |
1瓶 |
|
蛋白酶K |
1.1ml/管 |
1管 |
|
无菌无核酸酶水 |
600µl/管 |
1管 |
|
PCR扩增反应液 |
600µl/管 |
1管 |
|
实时荧光混合液 |
155µl/管 |
1管 |
|
阳性对照 |
600µl/管 |
1管 |
|
阴性对照 |
600µl/管 |
1管 |
|
DNA吸附柱和收集管 |
50套/袋 |
1袋 |
4 成品检验
4.1 性状 外观应密闭完好,无变形,组分齐全,无破损,无渗漏,标签字迹清晰。其中:
4.1.1 消化液 淡黄色澄清液体,装量为11ml/瓶,1瓶/盒。
4.1.2 DNA结合液 无色澄清液体,装量为11ml/瓶,1瓶/盒。
4.1.3 DNA洗涤液 无色澄清液体,装量为52ml/瓶,1瓶/盒。
4.1.4 DNA洗脱液 无色澄清液体,装量为4ml/瓶,1瓶/盒。
4.1.5 蛋白酶K 无色澄清液体,装量为1.1ml/管,1管/盒。
4.1.6 无菌无核酸酶水 无色澄清液体,装量为600µl/管,1管/盒。
4.1.7 PCR扩增反应液 无色澄清液体,装量为600µl/管,1管/盒。
4.1.8 实时荧光混合液 淡棕色液体,无沉淀,装量为155µl/管,1管/盒。
4.1.9 阳性对照 淡黄色澄清液体,装量为600µl/管,1管/盒。
4.1.10 阴性对照 淡黄色液体,有少量沉淀,装量为600µl/管,1管/盒。
4.1.11 DNA吸附柱和收集管 外观透亮、完整、无破损,离心柱层析膜乳白色无杂质,装量为50套/袋,1袋/盒。
4.2 无菌检验 按现行《中国兽药典》附录进行检验,消化液、DNA结合液、DNA洗涤液、DNA洗脱液、蛋白酶K、无菌无核酸酶水、PCR扩增反应液、实时荧光混合液、阳性对照和阴性对照均应无菌生长。
4.3 敏感性检验 按试剂盒“用法与判定”项对敏感性质控品(附注3)(ASFV/M1、ASFV/M2、ASFV/M3、ASFV/M4、ASFV/M5、ASFV/M6、ASFV/M7和ASFV/M8)进行检验,均应为阳性,且检测的Ct值符合以下关系:ASFV/M1<ASFV/M2<ASFV/M3,其中ASFV/M3的标准为32<Ct值<35。
4.4 特异性检验 按试剂盒“用法与判定”项对特异性质控品(附注4)(ASFV/T1、ASFV/T2、ASFV/T3、ASFV/T4、ASFV/T5、ASFV/T6、ASFV/T7、ASFV/T8和ASFV/T9)进行检验,均应为阴性。
5 作用与用途 用于猪全血、血清、脾脏、淋巴结、肌肉等组织样品及粪便样品中非洲猪瘟病毒DNA的检测。
6 用法与判定
6.1 用法
6.1.1 样品采集、保存及运输
6.1.1.1 样品采集
6.1.1.1.1 活猪样品 无菌采集EDTA抗凝血,或采血后按常规方法分离血清。
6.1.1.1.2 病死猪或屠宰猪样品 无菌采集脾脏、淋巴结、肌肉等组织样品。
6.1.1.1.3 病猪所处环境样品 采集粪便样品。
6.1.1.2 样品保存 所有待检样品在2~8℃保存应不超过24小时;在-20℃保存应不超过6个月;长期保存时,以-70℃以下为宜。
6.1.1.3 样品运输 样品一定要放置在有干冰或冰块的冷藏包中,保持全程冷链运输。要求在运输至实验室时,干冰仍覆盖标本或冰块仍未完全融化。
6.1.2 样品处理
6.1.2.1 抗凝血和血清处理 取抗凝血或血清200µl,置1.5ml灭菌离心管中。
6.1.2.2 组织样品处理 分别从待检组织三个不同的部位称取样品约1g,用手术剪剪碎混匀,再取0.05g于研磨器中研磨,加入1.5ml生理盐水继续研磨,待匀浆后转至1.5ml灭菌离心管中,8000r/min离心2分钟,取上清液200µl,置1.5ml灭菌离心管中。
6.1.2.3 粪便样品处理 取0.3g样品于研磨器中研磨,加入1.5ml生理盐水继续研磨,待匀浆后转至1.5ml灭菌离心管中,8000r/min离心2分钟,取上清液200µl,置1.5ml灭菌离心管中。
6.1.2.4 阳性对照处理 取阳性对照200µl,置1.5ml灭菌离心管中。
6.1.2.5 阴性对照处理 取阴性对照200µl,置1.5ml灭菌离心管中。
6.1.3 病毒DNA的提取
6.1.3.1 取已处理的样品、阴性对照和阳性对照,分别加入200µl消化液和20µl蛋白酶K,振荡混匀后,置56℃水浴中消化,每5分钟涡旋振荡一次,共消化15分钟。
6.1.3.2 从水浴锅中取出样品管,降至室温后,加入200μl DNA结合液,颠倒混匀,将全部液体移入吸附柱中(吸附柱要套上收集管,吸取液体时尽量不要吸到悬浮杂质,以免离心时堵塞吸附柱),室温静置3分钟,10000r/min离心30秒。
6.1.3.3 弃去收集管中液体,加入500μl DNA洗涤液,10000r/min离心30秒。
6.1.3.4 重复步骤6.1.3.3。
6.1.3.5 弃去收集管中液体,10000r/min空柱离心1分钟,以除去残留的DNA洗涤液。
6.1.3.6 将吸附柱放入新的1.5ml离心管中,向柱中央加入DNA洗脱液50μl,室温放置2分钟,10000r/min离心30秒,离心管中液体即为模板DNA。
6.1.4 实时荧光PCR操作
6.1.4.1 反应体系配制 设被检样品、阴性对照和阳性对照的份数总和为N,按如下反应体系配制:
|
无菌无核酸酶水 |
6.4×(N+1)µl |
|
PCR扩增反应液 |
10×(N+1)µl |
|
实时荧光混合液 |
2.6×(N+1)µl |
|
合计: |
19×(N+1)µl |
将以上配制的反应体系充分混匀后,分装至每个反应管中各19µl。分别取6.1.3.6中DNA 1µl,加入相应反应管中,盖紧管盖后5000r/min离心30秒。
6.1.4.2 扩增 将反应管放入荧光PCR仪内,记录样本摆放顺序。反应参数为95℃预变性2分钟;95℃变性5秒,58℃退火延伸15秒,共40个循环,荧光收集设置在每次循环的退火延伸结束时进行(报告基团“FAM”,淬灭基团“NONE”)。
6.2 判定
6.2.1 结果分析条件设定 阈值设定原则:阈值线超过阴性对照扩增曲线的最高点,且相交于阳性对照扩增曲线进入指数增长期的拐点,或根据仪器噪声情况进行调整。每个样品反应管内的荧光信号到达设定的阈值时所经历的循环数即为Ct值。
6.2.2 结果成立条件 阳性对照Ct值<30并出现特异的扩增曲线,阴性对照无Ct值且无特异的扩增曲线,试验结果成立。
6.2.3 结果判定
6.2.3.1 被检样品Ct值≤35并出现特异的扩增曲线,判为非洲猪瘟病毒核酸阳性。
6.2.3.2 被检样品无Ct值或Ct值≥40且无特异的扩增曲线,判为非洲猪瘟病毒核酸阴性。
6.2.3.3 被检样品35<Ct值<40并出现特异的扩增曲线,判为非洲猪瘟病毒核酸疑似,对疑似样品,需重新取样提取DNA,按双倍模板量(即2µl DNA)进行复检,Ct值<40并出现特异的扩增曲线判为阳性,否则判为阴性。
7 注意事项
7.1 所有试剂应在规定的温度下保存。
7.2 实验室应分配液区、模板提取区和扩增区。工作流程顺序为配液区→模板提取区→扩增区。各区器材试剂专用,不可跨区使用。实验结束后立即用1%次氯酸钠或75%酒精或紫外灯消毒工作台。
7.3 PCR扩增反应液应置于冰盒上使用,其余冷冻保存的试剂使用前应室温融化,再8000r/min离心15秒,使液体全部沉于管底。用毕所有试剂立即放回原处。
7.4 离心管、吸头等在实验前应全部高压灭菌。用灭菌的镊子夹取离心管,打开和盖上离心管盖时避免手和手套接触离心管口,若离心管开盖时有液体粘在手上或溅出,应立即更换手套。
7.5 提取的样品,短期内使用放置于2~8℃或冰上,长期应在-70℃以下保存,但仍以新鲜提取的样品效果最好。
7.6 反应体系在特定配液区配制,配制和分装反应体系时应尽量避免产生气泡,上机前,5000r/min离心30秒,检查各反应管是否盖紧,以免荧光物质泄露污染仪器,整个实验过程应严格控制污染。
7.7 严格遵守操作说明可以获得最好的结果。操作过程中移液、定时、转速等全部参数必须精确。
7.8 注意防止试剂盒组分受污染。不要使用超过有效期限的试剂,不同批次试剂盒之间的组分不要混用。
7.9 所有用于检测的废弃物品均应放入含消毒液的废物缸内,高压灭菌处理。
8 规格 50份/盒
9 贮藏与有效期 蛋白酶K、无菌无核酸酶水、PCR扩增反应液、实时荧光混合液、阳性对照和阴性对照-20℃以下保存,其他组分室温保存,有效期为9个月。
附注:
1 培养基的配制
1.1 含氨苄青霉素的LB培养基 称取10g胰蛋白胨、5g酵母提取物、10g氯化钠,加去离子水950ml充分溶解后,用10mol/L氢氧化钠调pH值至7.2,定容至1L,121℃高压灭菌20分钟。使用时加入终浓度为100μg/ml的氨苄青霉素。
1.2 含氨苄青霉素的LB琼脂平板 称取10g胰蛋白胨、5g酵母提取物、10g氯化钠、15g琼脂粉,加去离子水950ml充分溶解后,用10mol/L氢氧化钠调pH值至7.2,定容至1L,121℃高压灭菌20分钟,冷却至50℃左右,加入终浓度为100μg/ml的氨苄青霉素,充分摇匀,倒入平板中,待其自然凝固后,置2~8℃保存。
2 OIE推荐的非洲猪瘟病毒实时荧光PCR方法
2.1 引物及探针序列 引物1序列为5’-CTGCT-CATGG-TATCA-ATCTT-ATCGA-3’,引物2序列为5’-GATAC-CACAA-GATC(AG)-GCCGT-3’,探针序列为5’-[FAM]-CCACG- GGAGG-AATAC-CAACC-CAGTG-3’-[TAMRA]。
2.2 检测步骤
2.2.1 样品DNA提取 用商品化提取试剂盒提取样品DNA。
2.2.2 反应体系配制 每个样品25µl反应体系:无菌无核酸酶水7.5µl、2×PCR reaction master mix 12.5µl、50pmol/µl引物1 1µl、50pmol/µl引物2 1µl、5pmol/µl探针1µl、样品DNA 2µl。混匀后离心1分钟。
2.2.3 反应程序设置 将反应管放入荧光PCR仪内,设置反应程序:50℃ 2分钟;95℃ 10分钟;95℃ 15秒,58℃ 1分钟,40个循环,荧光收集设置在每次循环的退火延伸结束时进行(报告基团“FAM”,淬灭基团“NONE”)。
2.3 结果判定 阴性对照和阴性样品无Ct值或Ct值>40,阳性对照和阳性样品Ct值<40(强阳性样品Ct值<30)。
3 敏感性质控品制备和检验
3.1 ASFV/M1制备和检验
3.1.1 ASFV/M1制备 将按本规程制备的阳性对照用健康猪脾脏和淋巴结组织研磨液进行10倍稀释,以每管200µl分装后,标记为ASFV/M1。
3.1.2 ASFV/M1检验
3.1.2.1 性状 淡黄色液体。
3.1.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
3.1.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
3.1.2.4 规格 200µl/管
3.1.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
3.2 ASFV/M2制备和检验
3.2.1 ASFV/M2制备 将按本规程制备的阳性对照用健康猪脾脏和淋巴结组织研磨液进行100倍稀释,以每管200µl分装后,标记为ASFV/M2。
3.2.2 ASFV/M2检验
3.2.2.1 性状 淡黄色液体。
3.2.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
3.2.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
3.2.2.4 规格 200µl/管
3.2.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
3.3 ASFV/M3制备和检验
3.3.1 ASFV/M3制备 将按本规程制备的阳性对照用健康猪脾脏和淋巴结组织研磨液进行1000倍稀释,以每管200µl分装后,标记为ASFV/M3。
3.3.2 ASFV/M3检验
3.3.2.1 性状 淡黄色液体。
3.3.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
3.3.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性,且35<Ct值<38。
3.3.2.4 规格 200µl/管
3.3.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
3.4 ASFV/M4制备和检验
3.4.1 ASFV/M4制备 针对基因I型非洲猪瘟病毒合成其p72基因部分序列,由试剂公司合成序列后提供甘油菌。将甘油菌划线接种于含氨苄青霉素的LB琼脂平板上,37℃培养过夜;挑取单个菌落,接种于4ml含氨苄青霉素的LB培养基中,37℃ 220r/min振荡培养8小时;按0.8%(ml/ml)的比例接种于含氨苄青霉素的LB培养基中,37℃ 220r/min振荡培养12~16小时。将培养物使用商品化质粒提取试剂盒提取质粒,采用EcoRI限制性内切酶37℃消化1小时,72℃灭活15分钟,采用胶回收试剂盒再次纯化。纯化后的线性化质粒用紫外分光光度计检测,浓度应不低于30μg/ml,且不高于60μg/ml;经0.8%琼脂糖凝胶电泳,应仅在3.1kb处出现一条核酸带。将浓度与纯度测定均合格的线性化质粒与消化液以1∶10000的比例混匀,以每管200µl分装后,标记为ASFV/M4。
3.4.2 ASFV/M4检验
3.4.2.1 性状 淡黄色液体。
3.4.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
3.4.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
3.4.2.4 规格 200µl/管
3.4.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
3.5 ASFV/M5制备和检验
3.5.1 ASFV/M5制备 针对基因V型非洲猪瘟病毒合成其p72基因部分序列,由试剂公司合成序列后提供甘油菌。按附注3.4.1方法进行划线接种和培养。将培养物使用商品化质粒提取试剂盒提取质粒,采用EcoRI限制性内切酶37℃消化1小时,72℃灭活15分钟,采用胶回收试剂盒再次纯化。纯化后的线性化质粒用紫外分光光度计检测,浓度应不低于30μg/ml,且不高于60μg/ml;经0.8%琼脂糖凝胶电泳,应仅在3.1kb处出现一条核酸带。将浓度与纯度测定均合格的线性化质粒与消化液以1∶10000的比例混匀,以每管200µl分装后,标记为ASFV/M5。
3.5.2 ASFV/M5检验
3.5.2.1 性状 淡黄色液体。
3.5.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
3.5.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
3.5.2.4 规格 200µl/管
3.5.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
3.6 ASFV/M6制备和检验
3.6.1 ASFV/M6制备 针对基因VIII型非洲猪瘟病毒合成其p72基因部分序列,由试剂公司合成序列后提供甘油菌。按附注3.4.1方法进行划线接种和培养。将培养物使用商品化质粒提取试剂盒提取质粒,采用EcoRI限制性内切酶37℃消化1小时,72℃灭活15分钟,采用胶回收试剂盒再次纯化。纯化后的线性化质粒用紫外分光光度计检测,浓度应不低于30μg/ml,且不高于60μg/ml;经0.8%琼脂糖凝胶电泳,应仅在3.1kb处出现一条核酸带。将浓度与纯度测定均合格的线性化质粒与消化液以1∶10000的比例混匀,以每管200µl分装后,标记为ASFV/M6。
3.6.2 ASFV/M6检验
3.6.2.1 性状 淡黄色液体。
3.6.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
3.6.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
3.6.2.4 规格 200µl/管
3.6.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
3.7 ASFV/M7制备和检验
3.7.1 ASFV/M7制备 针对基因IX型非洲猪瘟病毒合成其p72基因部分序列,由试剂公司合成序列后提供甘油菌。按附注3.4.1方法进行划线接种和培养。将培养物使用商品化质粒提取试剂盒提取质粒,采用EcoRI限制性内切酶37℃消化1小时,72℃灭活15分钟,采用胶回收试剂盒再次纯化。纯化后的线性化质粒用紫外分光光度计检测,浓度应不低于30μg/ml,且不高于60μg/ml;经0.8%琼脂糖凝胶电泳,应仅在3.1kb处出现一条核酸带。将浓度与纯度测定均合格的线性化质粒与消化液以1∶10000的比例混匀,以每管200µl分装后,标记为ASFV/M7。
3.7.2 ASFV/M7检验
3.7.2.1 性状 淡黄色液体。
3.7.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
3.7.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
3.7.2.4 规格 200µl/管
3.7.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
3.8 ASFV/M8制备和检验
3.8.1 ASFV/M8制备 针对基因X型非洲猪瘟病毒合成其p72基因部分序列,由试剂公司合成序列后提供甘油菌。按附注3.4.1方法进行划线接种和培养。将培养物使用商品化质粒提取试剂盒提取质粒,采用EcoRI限制性内切酶37℃消化1小时,72℃灭活15分钟,采用胶回收试剂盒再次纯化。纯化后的线性化质粒用紫外分光光度计检测,浓度应不低于30μg/ml,且不高于60μg/ml;经0.8%琼脂糖凝胶电泳,应仅在3.1kb处出现一条核酸带。将浓度与纯度测定均合格的线性化质粒与消化液以1∶10000的比例混匀,以每管200µl分装后,标记为ASFV/M8。
3.8.2 ASFV/M8检验
3.8.2.1 性状 淡黄色液体。
3.8.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
3.8.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
3.8.2.4 规格 200µl/管
3.8.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
4 特异性质控品制备和检验
4.1 ASFV/T1制备和检验
4.1.1 ASFV/T1制备 购买商品化猪瘟活疫苗(每头份至少含150个兔体感染量),用生理盐水稀释成1头份/500µl,按1∶1比例加入消化液,混匀,室温静置15分钟,以每管200µl分装后,标记为ASFV/T1。
4.1.2 ASFV/T1检验
4.1.2.1 性状 淡黄色液体。
4.1.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
4.1.2.3 特异性 按国标GB/T 27540-2011《猪瘟病毒实时荧光RT-PCR检测方法》中实时荧光RT-PCR方法进行检验,应为阳性。
4.1.2.4 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
4.1.2.5 规格 200µl/管
4.1.2.6 贮藏与有效期 -70℃以下保存,有效期为12个月。
4.2 ASFV/T2制备和检验
4.2.1 ASFV/T2制备 购买商品化猪繁殖与呼吸综合征病毒活疫苗(每头份病毒含量≥105.0TCID50),用生理盐水稀释成1头份/500µl,按1∶1比例加入消化液,混匀,室温静置15分钟,以每管200µl分装后,标记为ASFV/T2。
4.2.2 ASFV/T2检验
4.2.2.1 性状 淡黄色液体。
4.2.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
4.2.2.3 特异性 按国标GB/T18090-2008《猪繁殖与呼吸综合诊断方法》中RT-PCR方法进行检验,应为阳性。
4.2.2.4 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
4.2.2.5 规格 200µl/管
4.2.2.6 贮藏与有效期 -70℃以下保存,有效期为12个月。
4.3 ASFV/T3制备和检验
4.3.1 ASFV/T3制备 购买商品化伪狂犬病活疫苗(每头份病毒含量≥5.0×103.0TCID50),用生理盐水稀释成1头份/500µl,按1∶1比例加入消化液,混匀,室温静置15分钟,以每管200µl分装后,标记为ASFV/T3。
4.3.2 ASFV/T3检验
4.3.2.1 性状 淡黄色液体。
4.3.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
4.3.2.3 特异性 按国标GB/T18641-2002《伪狂犬病诊断技术》中PCR方法进行检验,应为阳性。
4.3.2.4 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
4.3.2.5 规格 200µl/管
4.3.2.6 贮藏与有效期 -70℃以下保存,有效期为12个月。
4.4 ASFV/T4制备和检验
4.4.1 ASFV/T4制备 购买商品化猪圆环病毒2型灭活疫苗(全病毒灭活前每毫升病毒含量≥107.0TCID50),按1∶1比例加入消化液,混匀,室温静置15分钟,以每管200µl分装后,标记为ASFV/T4。
4.4.2 ASFV/T4检验
4.4.2.1 性状 乳白色液体,久置分层。
4.4.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
4.4.2.3 特异性 按国标GB/T21674-2008《猪圆环病毒聚合酶链反应试验方法》中PCR方法进行检验,应为阳性。
4.4.2.4 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
4.4.2.5 规格 200µl/管
4.4.2.6 贮藏与有效期 -70℃以下保存,有效期为12个月。
4.5 ASFV/T5制备和检验
4.5.1 ASFV/T5制备 取健康猪脾脏组织,用手术剪剪碎后于研磨器中研磨,按照质量体积比1∶30加入生理盐水继续研磨,待匀浆后转至灭菌离心管中,8000r/min离心2分钟,取上清液,再按1∶1比例分别加入消化液,混匀,室温静置15分钟,以每管200µl分装后,标记为ASFV/T5。
4.5.2 ASFV/T5检验
4.5.2.1 性状 淡黄色液体。
4.5.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
4.5.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
4.5.2.4 规格 200µl/管
4.5.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
4.6 ASFV/T6制备和检验
4.6.1 ASFV/T6制备 取健康猪淋巴结组织,用手术剪剪碎后于研磨器中研磨,按照质量体积比1∶30加入生理盐水继续研磨,待匀浆后转至灭菌离心管中,8000r/min离心2分钟,取上清液,再按1∶1比例分别加入消化液,混匀,室温静置15分钟,以每管200µl分装后,标记为ASFV/T6。
4.6.2 ASFV/T6检验
4.6.2.1 性状 淡黄色液体。
4.6.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
4.6.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
4.6.2.4 规格 200µl/管
4.6.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
4.7 ASFV/T7制备和检验
4.7.1 ASFV/T7制备 取健康猪EDTA抗凝全血,按1∶1比例加入消化液,混匀,室温静置15分钟,以每管200µl分装后,标记为ASFV/T7。
4.7.2 ASFV/T7检验
4.7.2.1 性状 黑红色液体。
4.7.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
4.7.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
4.7.2.4 规格 200µl/管
4.7.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
4.8 ASFV/T8制备和检验
4.8.1 ASFV/T8制备 取健康猪肌肉组织,用手术剪剪碎后于研磨器中研磨,按照质量体积比1∶30加入生理盐水继续研磨,待匀浆后转至灭菌离心管中,8000r/min离心2分钟,取上清液,再按1∶1比例加入消化液,混匀,室温静置15分钟,以每管200µl分装后,标记为ASFV/T8。
4.8.2 ASFV/T8检验
4.8.2.1 性状 淡黄色液体。
4.8.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
4.8.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
4.8.2.4 规格 200µl/管
4.8.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
4.9 ASFV/T9制备和检验
4.9.1 ASFV/T9制备 取健康猪粪便,于研磨器中研磨,按照质量体积比1∶5加入生理盐水继续研磨,待匀浆后转至灭菌离心管中,8000r/min离心2分钟,取上清液,再按1∶1比例加入消化液,混匀,室温静置15分钟,以每管200µl分装后,标记为ASFV/T9。
4.9.2 ASFV/T9检验
4.9.2.1 性状 淡黄色液体。
4.9.2.2 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
4.9.2.3 规格 200µl/管
4.9.2.4 贮藏与有效期 -70℃以下保存,有效期为12个月。
四、鳜传染性脾肾坏死病灭活疫苗(NH0618株)制造及检验试行规程
本品系用传染性脾肾坏死病毒NH0618株接种鳜仔鱼传代细胞(MFF-1),收获细胞培养物,经甲醛溶液灭活后,加矿物油佐剂混合乳化而成。用于预防鳜传染性脾肾坏死病。
1 毒种
1.1 制造及检验用毒种均为传染性脾肾坏死病毒NH0618株,由中山大学分离、鉴定;广东永顺生物制药股份有限公司保管、使用和供应。
1.2 毒种标准
1.2.1 病毒含量 将传染性脾肾坏死病毒NH0618株接种MFF-1细胞,采用半数细胞培养物感染量(TCID50)测定法测定病毒含量(附注1,下同),每毫升病毒含量应不低于107.0 TCID50。
1.2.2 毒力 将体重50~70g健康鳜(附注2,下同)在水温25~28℃循环水饲养7日以上。随机取50尾进行攻毒,攻毒前停止喂饲24小时,经背部肌肉注射NH0618株病毒液(含106.0TCID50/ml),每尾0.1ml。采用水温25~28℃循环水分箱饲养,连续观察14日,应至少45尾死亡(附注3,下同)。
1.2.3 免疫原性 将病毒液灭活后制成油乳剂灭活疫苗,每毫升疫苗含灭活前病毒量为106.0TCID50。将体重20~40g健康鳜在水温25~28℃循环水饲养7日以上。随机取120尾,分成2组,每组60尾,一组为免疫组,另一组为对照组,停止喂饲24小时后进行注射。免疫组经腹腔注射疫苗,每尾0.1ml;对照组经腹腔注射生理盐水,每尾0.1ml。采用水温25~28℃循环水分箱饲养21日后,免疫组和对照组各取50尾进行攻毒,攻毒前停止喂饲24小时,经背部肌肉注射NH0618株病毒液(含106.0TCID50/ml),每尾0.1ml。采用水温25~28℃循环水分箱饲养,连续观察14日,免疫组应至少45尾健活(附注4,下同),对照组应至少45尾死亡。
1.2.4 特异性 通过传染性脾肾坏死病毒主衣壳蛋白(MCP)基因进行特异性鉴定(附注5),应扩增出大小为1399bp的片段,测序结果应包含MCP gene CDs区1362bp全长,应与GenBank序列gb|AF371960.1一致。
1.2.5 纯净性 按现行《中国兽药典》附录进行检验,应无细菌、霉菌、支原体和外源病毒污染;采用PCR方法检测应无鳜蛙病毒(附注6,下同)和鳜弹状病毒(附注7,下同)污染。
1.2.6 基础种子代数 应不超过5代。
1.3 毒种保存 冻干毒种,-70℃以下保存,保存期为48个月。
2 细胞
2.1 细胞 制苗用细胞为MFF-1细胞,由中山大学建系、鉴定和保存,广东永顺生物制药股份有限公司保管、使用和供应。
2.2 细胞标准
2.2.1 细胞形态 细胞贴壁生长;在含10% 新生牛血清的DMEM营养液中,置26℃、5%CO2培养箱培养48~72小时,可形成良好单层,细胞呈上皮样,透明度大,折光性强,形态规则。
2.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.2.3 支原体检验 按现行《中国兽药典》附录进行检验,应无支原体生长。
2.2.4 外源病毒检验 按现行《中国兽药典》附录进行检验,应无外源病毒污染;同时采用PCR方法检测应无传染性脾肾坏死病毒(附注5.1,下同)、鳜蛙病毒和鳜弹状病毒污染。
2.2.5 胞核学检查 取50个处于有丝分裂中期的细胞进行检查,染色体众数应为48,占总细胞数的40~60%。
2.2.6 致瘤性检验
2.2.6.1 裸鼠致瘤试验 用无胸腺裸鼠至少10只,各皮下注射107个MFF-1细胞。同时用人宫颈癌细胞(HeLa)皮下注射无胸腺裸鼠,每只106个细胞,作为阳性对照;用鸡胚成纤维细胞(CEF)皮下注射无胸腺裸鼠,每只107个细胞,作为阴性对照。观察21日后,MFF-1细胞组和阴性对照组应无肿瘤形成,阳性对照组应出现明显的肿瘤。
2.2.6.2 软琼脂集落形成试验 将MFF-1细胞接种软琼脂(附注8),同时设HeLa细胞为阳性对照,CEF细胞为阴性对照。观察21日后,MFF-1细胞组和阴性对照组应不形成集落,阳性对照组应形成明显的集落。
2.3 细胞代数 原始细胞库细胞代数为F1~F10,基础细胞库细胞代数为F20内,工作细胞库细胞代数为F30内,生产用细胞传代应不超过30代。
2.4 保存 液氮中保存,保存期为60个月。
3 疫苗制造及半成品检验
3.1 生产用毒种制备
3.1.1 毒种繁殖 将MFF-1细胞置26℃、5%CO2培养箱中培养48~72小时,形成致密单层,将冻干毒种用DMEM营养液恢复至原量,按1︰1000(v/v)的量接种毒种,加入含2%新生牛血清的DMEM维持液继续培养,当细胞病变(CPE)达到80%以上时收获病毒液,-20℃以下反复冻融3次。将病毒液定量分装,注明名称、收获日期、毒种代次等。-20℃以下保存。
3.1.2 毒种鉴定 按本规程1.2.1、1.2.4和1.2.5项进行,应符合规定。
3.1.3 毒种保存 -20℃以下保存,应不超过6个月。
3.1.4 毒种继代 应不超过5代。
3.2 制苗用病毒液的制备
3.2.1 细胞制备 将冻存的细胞从液氮中取出后,立即置30℃水浴中快速融解,然后以1000 r/min离心5分钟,倾去上清液,加入含10% 新生牛血清的DMEM营养液分散悬浮细胞,移入培养瓶中,置26℃、5%CO2培养箱培养48~72小时,形成良好单层。
3.2.2 细胞扩大培养 用0.25%胰酶溶液消化细胞,按1︰3比例传代,接种到细胞转瓶中,调整转瓶转速为8~10转/小时,26℃培养48~72小时。
3.2.3 接种 当细胞长至致密单层时,将毒种按1︰1000(v/v)的量接种细胞,加入含2%新生牛血清的DMEM维持液继续培养。
3.2.4 观察与收获 接毒后,逐日观察,记录细胞病变情况,当CPE达到80%以上时收获,-20℃以下反复冻融3次。-20℃以下保存,应不超过6个月。
3.3 灭活 加入终浓度为0.1%(v/v)的甲醛溶液,充分混匀,26℃灭活48小时,取样进行灭活检验后,立即置2~8℃保存,应不超过21日。
3.4 半成品检验
3.4.1 病毒含量测定 取灭活前的病毒液测定病毒含量,每毫升病毒含量应不低于107.0 TCID50。
3.4.2 无菌检验 取灭活前病毒液及灭活病毒液按现行《中国兽药典》附录进行检验,应无菌生长。
3.4.3 灭活检验 取灭活病毒液作10倍稀释后,接种MFF-1单层细胞(25cm2细胞瓶),每个样品接种3瓶,每瓶1ml,吸附1小时后弃去,于每瓶中加入DMEM维持液10ml,另设1瓶未接种的细胞为空白对照,置26℃、5%CO2培养箱中培养5日,逐日观察是否有CPE产生,若无CPE产生则将上一代的细胞冻融液再接种到下一代细胞瓶中,不弃接种液继续培养,如此进行,将细胞液盲传2代,应无CPE产生。
3.5 疫苗制备
3.5.1 油相制备 将已加入2%硬脂酸铝(w/v)的注射用白油和司本-80按94︰6(v/v)配比,加热搅拌至透明,高压灭菌后冷却备用。
3.5.2 水相制备 用灭菌PBS将灭活病毒液调整至含灭活前病毒量为107.0TCID50/ml,将灭菌的吐温-80和灭活病毒液按4︰96(v/v)配比,充分混匀,至吐温-80完全溶解为止。
3.5.3 乳化 水相与油相以1︰2(v/v)比例乳化。将油相导入乳化罐中,开动电机低速搅拌,同时缓慢加入水相,以5000r/min乳化10分钟。
3.5.4 分装 将乳化好的疫苗定量分装,加盖密封、粘贴标签,2~8℃保存。
4 成品检验
4.1 性状
4.1.1 外观 乳白色均匀乳剂。
4.1.2 剂型 为油包水型。取一清洁吸管,吸取少量疫苗滴于冷水表面,除第一滴外,均应不扩散。
4.1.3 稳定性 吸取疫苗10ml加入离心管中,以3000r/min离心15分钟,管底析出水相应不超过0.5ml。
4.1.4 黏度 按现行《中国兽药典》附录进行检验,应符合规定。
4.2 装量检查 按现行《中国兽药典》附录进行检验,应符合规定。
4.3 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
4.4 安全检验 将体重20~40g健康鳜在水温25~28℃循环水饲养7日以上。随机取100尾,分为2组,每组50尾,一组为免疫组,另一组为对照组,停止喂饲24小时后进行注射。免疫组经腹腔注射疫苗,每尾0.2ml;对照组经腹腔注射生理盐水,每尾0.2ml。采用水温25~28℃循环水分箱饲养,连续观察14日,免疫组和对照组应全部健活,若有非特异性死亡(附注9),每组应不超过3尾。
4.5 效力检验 将体重20~40g健康鳜在水温25~28℃循环水饲养7日以上。随机取120尾,分成2组,每组60尾,一组为免疫组,另一组为对照组,停止喂饲24小时后进行注射。免疫组经腹腔注射疫苗,每尾0.1ml;对照组经腹腔注射生理盐水,每尾0.1ml。采用水温25~28℃循环水分箱饲养21日后,免疫组和对照组各取50尾进行攻毒,攻毒前停止喂饲24小时,经背部肌肉注射NH0618株病毒液(含106.0TCID50/ml),每尾0.1ml。采用水温25~28℃循环水分箱饲养,连续观察14日,免疫组应至少45尾健活,对照组应至少45尾死亡。
4.6 甲醛残留量测定 按现行《中国兽药典》附录进行测定,应符合规定。
5 作用与用途 用于预防鳜传染性脾肾坏死病。免疫期为6个月。
6 用法与用量 腹腔注射。20g以上的鳜每尾注射0.1ml。
7 注意事项
7.1 仅用于接种健康鳜。
7.2 疫苗贮藏及运输过程中切勿冻结,启封后应在4小时内用完,长时间暴露在高温下会影响疫苗效力,使用前使疫苗恢复至室温并充分摇匀。
7.3 使用前应仔细检查包装,如发现破损、残缺、文字模糊、过期失效等,则禁止使用。
7.4 禁止与其他疫苗合用。
7.5 疫苗使用前,鱼应停止喂饲24小时。注射接种时,建议戴上棉布手套抓鱼并轻拿轻放,尽量避免因操作不当造成鱼的损伤。接种时应避开阴雨闷热天气,以防止供氧不足造成鱼的死亡。
7.6 应使用无菌的注射器。
7.7 如意外将疫苗污染到人的眼、鼻、口中或注射到人体内时,应及时对患部采取消毒等措施。必要时,请医疗人员予以治疗。
7.8 用过的疫苗瓶、器具和未用完的疫苗等应进行无害化处理。
8 规格 (1)20ml/瓶 (2)50ml/瓶 (3)100ml/瓶 (4)250ml/瓶 (5)500ml/瓶
9 贮藏与有效期 2~8℃保存,有效期为12个月。
附注:
1 半数细胞培养物感染量(TCID50)测定法
将MFF-1细胞悬液加至96孔微量培养板中,每孔100μl(细胞密度约为4×105.0个/ml),置26℃、5%CO2培养箱培养48小时,使MFF-1细胞形成单层。将病毒液用无血清DMEM培养基作10倍系列稀释,取10-5、10-6、10-7、10-8 4个稀释度接种于单层细胞的96孔微量培养板中,每个稀释度8个孔,每孔100μl,同时设正常细胞对照8孔,最后于每孔中补加4%新生牛血清的维持液,每孔100μl,继续培养7日,观察细胞病变,按Reed-Muench法计算TCID50。
2 健康鳜判定标准 符合以下所有特征者,判定为健康鳜。
2.1 头部、吻部、鳃盖、鳍条等部位均无充血。
2.2 肥满度均匀,无畸形,体表完好,有光泽,无擦痕,无掉鳞。
2.3 鳃丝整齐完好、色泽鲜红、无异物。
2.4 体表和鳃无寄生虫和霉菌感染。
2.5 摄食正常。
2.6 鱼群多聚集在箱底,对外界惊扰反应灵敏。
2.7 根据鱼群大小,随机抽取一定数量鳜(100尾以下的鱼群随机抽取5尾,100~500尾的鱼群随机抽取10尾,500尾以上的鱼群随机抽取20尾),取脾脏采用PCR方法检测传染性脾肾坏死病毒、鳜蛙病毒和弹状病毒,结果应均为阴性。
3 特异性死亡鳜判定标准 符合以下全部特征者,判为特异性死亡。
3.1 攻毒72小时后死亡。
3.2 体表完好、无光泽,体色变黑。
3.3 鳃丝整齐完好、鳃褪色。
3.4 解剖后,脾脏、肾脏肿大,呈暗红色。
4 健活鳜判定标准 符合以下所有特征者,判定为健活鳜。
4.1 体表完好,有光泽。
4.2 摄食正常。
4.3 鱼群多聚集在箱底,对外界惊扰反应灵敏。
5 传染性脾肾坏死病毒特异性鉴定
5.1 传染性脾肾坏死病毒PCR检测
5.1.1 引物
上游引物 5’-TCATTGTCATCATCATGTCTGC-3’;
下游引物 5’- AGACACACGGGGCAATC-3’;
预期扩增片段大小为1399bp。
5.1.2 样品处理
5.1.2.1 待检样品 组织样品,取组织按1︰9(w/v)加入PBS(0.01mol/L,pH值7.2),冰浴后匀浆,3000r/min4℃离心10分钟,取上清200μl;细胞培养物样品,取培养物200μl。
5.1.2.2 阳性对照 取传染性脾肾坏死病毒阳性病毒液200μl。
5.1.2.3 阴性对照 取PBS(0.01mol/L,pH值7.2)200μl。
5.1.2.4 DNA提取 取待检样品、阳性对照和阴性对照,按照商品化DNA提取试剂盒的说明书进行DNA提取。
5.1.3 PCR反应
反应体系 10×PCR Buffer 2.5μl,dNTPs 2.0μl,上、下游引物各1.0 μl,Taq酶0.5μl, DNA模板1.0μl,加双蒸水至25μl体系。
反应程序 94℃预变性3分钟;94℃变性60秒,58℃退火60秒,72℃延伸60秒,共30个循环;72℃延伸7分钟。
5.1.4 电泳 PCR扩增产物按1︰9加入10×上样缓冲液后,取10μl使用浓度为1%的琼脂糖凝胶进行电泳。120V电泳20min后在波长为254nm或312nm的紫外灯下观察。
5.1.5 结果判定 阳性对照出现1399bp电泳条带,阴性对照无扩增条带,试验成立。出现1399bp扩增条带的样品为传染性脾肾坏死病毒阳性。
5.2 测序 对5.1的扩增产物进行测序,测序结果应包含MCP gene CDs区1362bp全长,应与GenBank序列gb|AF371960.1一致。
6 鳜蛙病毒PCR检测方法
6.1 引物
上游引物 5’-GGAATTCATGTCTTCTGTAACTGGTTCAG-3’;
下游引物 5’-CCGCTCGAGTTACAAGATTGGGAATCCCATCGAG-3’;
预期扩增片段大小为1392bp。
6.2 样品处理
6.2.1 待检样品 组织样品,取组织按1︰9(w/v)加入PBS(0.01mol/L,pH值7.2),冰浴后匀浆,3000r/min 4℃离心10分钟,取上清200μl;细胞培养物样品,取培养物200μl。
6.2.2 阳性对照 取鳜蛙病毒阳性病毒液200μl。
6.2.3 阴性对照 取PBS(0.01mol/L,pH值7.2)200μl。
6.2.4 DNA提取 取待检样品、阳性对照和阴性对照,按照DNA提取试剂盒的说明书进行DNA提取。
6.3 PCR反应
反应体系 10×PCR Buffer 2.5μl,dNTPs 2.0μl,上、下游引物各1.0 μl,Taq 酶0.5μl,DNA模板1.0μl,加双蒸水至25μl。
反应程序 94℃预变性3分钟;94℃变性30秒,52℃退火30秒,72℃延伸60秒,共30个循环;72℃延伸7分钟。
6.4 电泳 PCR扩增产物按1︰9加入10×上样缓冲液后,取10μl使用浓度为1%的琼脂糖凝胶进行电泳。120V电泳20min后在波长为254nm或312nm的紫外灯下观察。
6.5 结果判定 阳性对照出现1392bp电泳条带,阴性对照无扩增条带,试验成立。出现1392bp扩增条带的样品为鳜蛙病毒阳性。
7 鳜弹状病毒RT-PCR检测方法
7.1 引物
上游引物 5’- CGTGGTCCGCTATCTCTGT-3’;
下游引物 5’- AGTGTTGCCTCCGATGTCA-3’;
预期扩增片段大小为850bp。
7.2 样品处理
7.2.1 待检样品 组织样品,取组织按1︰9(w/v)加入PBS(0.01mol/L,pH值7.2),冰浴后匀浆,3000r/min4℃离心10分钟,取上清200μl;细胞培养物样品,取培养物200μl。
7.2.2 阳性对照 取鳜弹状病毒阳性病毒液200μl。
7.2.3 阴性对照 取PBS(0.01mol/L,pH值7.2)200μl。
7.2.4 RNA提取 取待检样品、阳性对照和阴性对照,按照DNA提取试剂盒的说明书进行RNA提取。
7.3 RT-PCR反应
反应体系 2×RT-PCR预混液12.5μl,上、下游引物各1.0 μl,RNA模板2.0μl,加无RNA酶水至25μl。
反应程序 50℃反转录30分钟;94℃预变性3分钟;94℃变性30秒,55℃退火30秒,72℃延伸60秒,共30个循环;72℃延伸7分钟。
7.4 电泳 RT-PCR扩增产物按1︰9加入10×上样缓冲液后,取10μl使用浓度为1%的琼脂糖凝胶进行电泳。120V电泳20min后在波长为254nm或312nm的紫外灯下观察。
7.5 结果判定 阳性对照出现850bp电泳条带,阴性对照无扩增条带,试验成立。出现850bp扩增条带的样品为鳜弹状病毒阳性。
8 软琼脂集落形成试验
8.1 制备2×DMEM营养液(含1000 IU/ml青霉素,1000μg/ml链霉素和20%胎牛血清),30℃保存备用。
8.2 分别制备浓度为1.2%和0.8%的低熔点琼脂糖溶液,121℃高压灭菌后,维持30℃勿使其凝固。
8.3 按1︰1比例均匀混合1.2%低熔点琼脂糖溶液和2×DMEM营养液,取3 ml混合液注入直径6 cm平皿中作为下层琼脂,冷却凝固后置5%CO2培养箱中备用。
8.4 按1︰1比例混合0.8%低熔点琼脂糖溶液和2×DMEM营养液于无菌试管中,向管中加入待检细胞悬液至细胞密度为103个/ml,设相同数量的人宫颈癌细胞(HeLa)为阳性对照,鸡胚成纤维细胞(CEF)为阴性对照。
8.5 充分混匀后,取3ml混合液注入已铺有下层琼脂的平皿中,凝固后形成上层琼脂,每种细胞接种3个直径6 cm平皿,分别采用最适培养条件培养。
8.6 观察21日,记录细胞集落形成情况。若有50个细胞以上的克隆形成,则判定为集落形成阳性,否则判定为阴性。
9 非特异性死亡鳜判定标准 除附注3特异性死亡外,其他的死亡均判定为非特异性死亡。
附件3
鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)等8种兽药产品质量标准
一、鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)质量标准
鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)
Jichuanranxingbiyan(A Xing,C Xing)Erjia Miehuoyimiao(YT Zhu+ JN Zhu)
Coryza(Serotype A,Serotype C)Vaccine,Inactivated(Strain YT + Strain JN)
本品系用副鸡禽杆菌A型YT株和C型JN株分别接种于适宜培养基培养,收获培养物,用硫柳汞灭活后浓缩,加氢氧化铝胶制成。用于预防由A型和C型副鸡禽杆菌引起的鸡传染性鼻炎。
【性状】 静置后,上层为澄清液体,下沉为灰白色沉淀,振摇后呈均匀混悬液。
【装量检查】 按现行《中国兽药典》附录进行检验,应符合规定。
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【安全检验】 用4~5周龄的SPF鸡10只,各颈部皮下注射疫苗1.0ml,观察14日,应全部健活,且不出现因疫苗引起的局部和全身不良反应。
【效力检验】 用4~6周龄SPF鸡40只,其中20只各皮下注射疫苗0.5ml,另20只作对照,同条件饲养。接种后21日,取免疫鸡10只和对照鸡10只分别眶下窦内注射一个最小发病剂量的YT株强毒菌液(附注1)0.2ml;另取免疫鸡10只和对照鸡10只分别眶下窦内注射一个最小发病剂量的 JN株强毒菌液(附注1)0.2ml。攻毒后观察7日。各对照组应至少8只发病(攻毒鸡出现面部一侧或两侧眶下窦及周围肿胀或流鼻涕任一症状即判为发病),各免疫组应至少8只保护。
【汞类防腐剂残留量测定】 按现行《中国兽药典》附录进行测定,应符合规定。
【作用与用途】 用于预防由A型和C型副鸡禽杆菌引起的鸡传染性鼻炎。一次免疫,免疫期为4个月,二次免疫,免疫期为9个月。
【用法与用量】 颈背部皮下注射。4周龄以上鸡,每只0.5ml;建议首免后3个月加强免疫1次,每只0.5ml。
【注意事项】 (1)仅适用于接种健康鸡。
(2)疫苗启封后,限当日用完。
(3)切忌冻结,使用前应将疫苗温度恢复至室温,使用时应充分摇匀。
(4)注射器具应严格消毒,接种时注射部位应进行局部消毒处理。
(5)用过的疫苗瓶、注射器和未用完的疫苗等应进行无害化处理。
【规格】 (1)20ml/瓶 (2)100ml/瓶 (3)250ml/瓶 (4)500ml/瓶
【贮藏与有效期】 2~8℃保存,有效期为15个月。
附注:
1 攻毒菌液1个最小发病量的测定和制备方法
1.1 1个最小发病量的测定
取-40℃保存的冻干菌种1瓶,采用鸡肉汤琼脂培养基(附注2),按现行《中国兽药典》附录进行活菌计数,然后再取相同批次相同保存条件的另1支菌种用鸡肉汤培养基稀释成不同的稀释度(1.0×103CFU、5.0×103CFU、2.5×104CFU、1.25×105CFU/ml),每个稀释度各眶下窦注射7~9周龄SPF鸡10只,每只0.2ml,每日观察记录鸡的发病情况,观察7日。当试验鸡出现面部一侧或两侧眶下窦及周围肿胀或流鼻涕任一症状即判为发病,能使8只试验鸡发病的最小攻毒剂量就定为最小发病剂量。
1.2 1个最小发病量攻毒菌液的制备方法
攻毒前取相同批次相同保存条件的冻干菌种用鸡肉汤培养基稀释至相应最小发病剂量的菌液浓度,即为攻毒菌液。
2 培养基制备
2.1 鸡肉汁
取鸡胸脯肉泥1份加蒸馏水2份,置2~8℃浸泡过夜,煮沸30分钟,除去肉渣,澄清过滤。
2.2 鸡肉汤培养基
鸡肉汁100ml
酪蛋白胨 1g
氯化钠 0.5g
调pH值至7.2,115℃灭菌30分钟,用前加入过滤除菌的新鲜酵母浸出液20ml、健康鸡血清5ml和终浓度为15μg/ml的NADH(辅酶I)溶液。
2.3 鸡肉汤琼脂
在鸡肉汤中加入1.5%琼脂粉热溶即成。但要在倒平板前(50~60℃时)加入终浓度为15μg/ml的NADH(辅酶I)溶液和10%的健康鸡血清。
二、非洲猪瘟病毒荧光等温扩增检测试剂盒质量标准
非洲猪瘟病毒荧光等温扩增检测试剂盒
African Swine Fever Virus Real-time isothermal amplification Detection Kit
Feizhou Zhuwenbingdu Yingguang Dengwenkuozeng Jiance Shijihe
本品系用非洲猪瘟病毒 VP72 基因设计合成的三对特异性引物组成的荧光等温扩增反应液,以携带非洲猪瘟病毒 VP72 基因的质粒 pMD20-T-VP72 为阳性对照,以 DEPC 处理水为阴性对照,以 Bst DNA 聚合酶及矿物油等组分组装而成,用于血液、血球粉、淋巴结、脾脏、扁桃体、肌肉中的非洲猪瘟病毒核酸的检测。
【性状】 试剂盒的外包装应无破损,印刷文字和图案正确;产品批号、保存条件和有效期标示正确无误。内包装应无破损、无裂痕、无渗漏,品名、批号、保存条件、有效期等清晰。
其中:
荧光等温扩增反应液 无色透明澄清液体,装量为 1100μl/管,共 1 管。
Bst DNA 聚合酶 无色透明粘稠液体,装量为 50μl/管,共 1 管。
阴性对照 无色透明液体,装量为 1000μl/管,共 1 管。
阳性对照 无色透明液体,装量为 200μl/管,共 1 管。
矿物油 无色透明粘稠液体,装量为 1000μl/管,共 1 管。
【无菌检验】 按现行《中国兽药典》附录进行无菌检验,荧光等温扩增反应液、阴性对照及阳性对照均应无菌生长。
【敏感性检验】 将敏感性质控品用 DEPC 处理水作 1︰10、1︰100、1︰1000、1︰10000、
1︰100000 稀释(附注 1),按照试剂盒“用法与判定”进行检测和判定,1︰1000 以内稀释时结果应为阳性,1︰10000 稀释时结果可为阳性或阴性,1︰100000 稀释时结果应为阴性。
【特异性检验】 按照试剂盒“用法与判定”对特异性质控样品 T1、T2、T3、T4、T5、T6、T7、T8(见附注 2)进行检测和判定,T1、T2、T3、T4、T5、T6、T7、T8 的结果应
为阴性。
【作用与用途】 用于血液、血球粉、淋巴结、脾脏、扁桃体、肌肉中非洲猪瘟病毒核酸的检测。
【用法与判定】
1 用法
1.1 样品处理
血液样品:用双蒸水作 1︰5 稀释后备用;淋巴结、脾脏、扁桃体、肌肉样品,用无菌的剪刀和镊子剪取待检样品 2.0 g 于研钵中充分研磨,再加 10.0 ml PBS(pH 7.2,含1万单位青霉素和 1 万单位链霉素)混匀(样品不足2.0 g 按1︰5比例加 PBS),3000 r/min,4 ℃离心5分钟,取上清液,编号备用;血球粉处理同上,只不过省掉研磨步骤。
1.1.2 样品存放 采集或处理好的样品在 2~8℃条件下保存应不超过24小时;若需长期保存,须放置-80℃冰箱,但应避免反复冻融(冻融不超过3次)。
1.3 操作步骤
(1)反应预混液的配制 按照下表配制反应预混液(注:配制和分装反应预混液时应在冰盒上进行)。按照n+2 管配制(n = 样品数)。
反应预混液的配制
|
序号 |
组份 |
1头份样品的量(μl) |
(n+2)头份样品的量(μl) |
|
1 |
荧光等温扩增反应液 |
22 |
22×(n+2) |
|
2 |
Bst DNA聚合酶 |
1.0 |
1.0 ×(n+2) |
(2)反应预混液分装 取n+2 个 0.2ml PCR管,将配制的反应预混液涡旋混匀,瞬时离心后,按每管 23μl分装于PCR管内。
(3)每管加入 20μl矿物油。
(4)加样 向对应的PCR管底部加入上述处理的样品 2.0μl。同时,向阳性对照管内加入2.0 μl阳性对照,向阴性对照管内加入 2.0μl DEPC水。盖紧管盖,瞬时离心,转移至检测区。
(5)检测 将离心后的PCR管放入检测仪内(专用配套仪器或普通的荧光PCR仪均可),设定好被检样品(S)、阳性对照(PC)、阴性对照(NC)的位置。反应参数设置:采用 64℃ 60分钟,每 1分钟采集一次FAM通道荧光信号,共采集 60 次。
2 判定
2.1 结果分析条件的设定 阈值设定原则:根据仪器噪声情况进行调整,以阈值线刚好超过阴性对照品扩增曲线的最高点为准。
2.2 质控标准
2.2.1 阴性对照无 Tt 值并且无扩增曲线即S型扩增曲线。
2.2.2 阳性对照的 Tt 值应小于或等于45,并出现典型的扩增曲线。
2.2.3 如阴性和阳性对照不满足以上条件,此次实验视为无效。
2.3 结果判定
2.3.1 阴性:无 Tt 值,且无特征性扩增曲线,表明样品为阴性。
2.3.2 阳性:Tt 值≤45,且出现典型的扩增曲线,表示样品为阳性。
2.3.3 Tt 值>45,且出现典型的扩增曲线的样品建议复验,复验仍出现上述结果的,判为阳性,否则判为阴性。
2.3.4 出现Tt值但无特征性扩增曲线的样品,判定为阴性。
【注意事项】 (1)实验前请仔细阅读本试剂盒说明书,请严格按照操作步骤进行检测。反应液在使用前要彻底融化。分装反应液时,应尽量避免产生气泡。上机前注意检查各反应管是否盖紧,以免交叉污染。阳性对照在吸取前应瞬时离心后使用。
(2)本试剂盒需-20℃保存,并在有效期内使用。试剂盒中各组分应避免反复冻融。
(3)鉴于ASFV为一类检疫性疫病,上述操作应在相关生物安全设施内进行。对样品及其废弃物的操作应严格遵守生物安全规定。
(4)扩增完的PCR管切勿打开,以防污染。
(5)本试剂盒仅供兽医诊断使用。
【规格】 48 检测/盒
【贮藏与有效期】 -20℃保存,有效期为12个月。
附注
1 敏感性质控样品标准
【性状】 无色透明液体
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【核酸检测】 采用扩增VP72基因的PCR对敏感性质控品进行检测,PCR完毕,用 1%琼脂糖凝胶电泳对扩增产物进行检测,在1941bp处出现条带,结果为阳性。
【规格】 200μl/管
【贮藏与有效期】 -80℃保存,有效期为24个月。
2 特异性质控样品(T1~T8)标准
2.1 正常猪肝脏 10%悬液(T1)
【性状】 红褐色液体
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【核酸检测】 提取核酸后,采用非洲猪瘟病毒实时荧光 PCR 检测方法检测,应为阴性。
【规格】 300μl/管
【贮藏与有效期】 -80℃保存,有效期为24个月。
2.2 正常猪 10%血液(T2)
【性状】 红褐色液体
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【核酸检测】 提取核酸后,采用非洲猪瘟病毒实时荧光 PCR 检测方法检测,应为阴性。
【规格】 300μl/管
【贮藏与有效期】 -80℃保存,有效期为24个月。
2.3 伪狂犬病毒核酸(T3)
【性状】 无色透明液体
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【核酸检测】 采用伪狂犬病毒实时荧光PCR检测方法检测,应为阳性。
【规格】 300μl/管
【贮藏与有效期】 -80℃保存,有效期为24个月。
2.4 猪细小病毒核酸(T4)
【性状】 无色透明液体
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【核酸检测】 采用猪细小病毒实时荧光PCR检测方法检测,应为阳性。
【规格】 300μl/管
【贮藏与有效期】 -80℃保存,有效期为24个月。
2.5 猪圆环病毒 2 型核酸(T5)
【性状】 无色透明液体
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【核酸检测】 采用猪圆环病毒 2 型实时荧光PCR检测方法检测,应为阳性。
【规格】 300μl/管
【贮藏与有效期】 -80℃保存,有效期为24个月。
2.6 正常猪淋巴结 10%悬液(T6)
【性状】 褐色或白色液体
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【核酸检测】 提取核酸后,采用非洲猪瘟病毒实时荧光PCR检测方法检测,应为阴性。
【规格】 300μl/管
【贮藏与有效期】 -80℃保存,有效期为24个月。
2.7 正常猪肌肉 10%悬液(T7)
【性状】 褐色或白色液体
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【核酸检测】 提取核酸后,采用非洲猪瘟病毒实时荧光PCR检测方法检测,应为阴性。
【规格】 300μl/管
【贮藏与有效期】 -80℃保存,有效期为24个月。
2.8 正常猪脾脏 10%悬液(T8)
【性状】 红褐色液体
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【核酸检测】 提取核酸后,采用非洲猪瘟病毒实时荧光PCR检测方法检测,应为阴性。
【规格】 300μl/管
【贮藏与有效期】 -80℃保存,有效期为24个月。
三、非洲猪瘟病毒荧光PCR检测试剂盒质量标准
非洲猪瘟病毒荧光PCR检测试剂盒
Feizhouzhuwen Bingdu Yingguang PCR Jiance Shijihe
African Swine Fever Virus Real Time PCR Detection Kit
本试剂盒系由消化液、DNA结合液、DNA洗涤液、DNA洗脱液、蛋白酶K、无菌无核酸酶水、PCR扩增反应液、实时荧光混合液、阳性对照、阴性对照、DNA吸附柱和收集管组装而成。用于猪全血、血清、脾脏、淋巴结、肌肉等组织样品及粪便样品中非洲猪瘟病毒DNA的检测。
【性状】 外观应密闭完好,无变形,组分齐全,无破损,无渗漏,标签字迹清晰。其中:
消化液 淡黄色澄清液体,装量为11ml/瓶,1瓶/盒。
DNA结合液 无色澄清液体,装量为11ml/瓶,1瓶/盒。
DNA洗涤液 无色澄清液体,装量为52ml/瓶,1瓶/盒。
DNA洗脱液 无色澄清液体,装量为4ml/瓶,1瓶/盒。
蛋白酶K 无色澄清液体,装量为1.1ml/管,1管/盒。
无菌无核酸酶水 无色澄清液体,装量为600µl/管,1管/盒。
PCR扩增反应液 无色澄清液体,装量为600µl/管,1管/盒。
实时荧光混合液 淡棕色液体,无沉淀,装量为155µl/管,1管/盒。
阳性对照 淡黄色澄清液体,装量为600µl/管,1管/盒。
阴性对照 淡黄色液体,有少量沉淀,装量为600µl/管,1管/盒。
DNA吸附柱和收集管 外观透亮、完整、无破损,离心柱层析膜乳白色无杂质,装量为50套/袋,1袋/盒。
【无菌检验】 按现行《中国兽药典》附录进行检验,消化液、DNA结合液、DNA洗涤液、DNA洗脱液、蛋白酶K、无菌无核酸酶水、PCR扩增反应液、实时荧光混合液、阳性对照和阴性对照均应无菌生长。
【敏感性检验】 按试剂盒“用法与判定”项对敏感性质控品(附注1)(ASFV/M1、ASFV/M2、ASFV/M3、ASFV/M4、ASFV/M5、ASFV/M6、ASFV/M7和ASFV/M8)进行检验,均应为阳性,且检测的Ct值符合以下关系:ASFV/M1<ASFV/M2<ASFV/M3,其中ASFV/M3的标准为32<Ct值<35。
【特异性检验】 按试剂盒“用法与判定”项对特异性质控品(附注2)(ASFV/T1、ASFV/T2、ASFV/T3、ASFV/T4、ASFV/T5、ASFV/T6、ASFV/T7、ASFV/T8和ASFV/T9)进行检验,均应为阴性。
【作用与用途】 用于猪全血、血清、脾脏、淋巴结、肌肉等组织样品及粪便样品中非洲猪瘟病毒DNA的检测。
【用法与判定】
1 用法
1.1 样品采集、保存及运输
1.1.1 样品采集
1.1.1.1 活猪样品 无菌采集EDTA抗凝血,或采血后按常规方法分离血清。
1.1.1.2 病死猪或屠宰猪样品 无菌采集脾脏、淋巴结、肌肉等组织样品。
1.1.1.3 病猪所处环境样品 采集粪便样品。
1.1.2 样品保存 所有待检样品在2~8℃保存应不超过24小时;在-20℃保存应不超过6个月;长期保存时,以-70℃以下为宜。
1.1.3 样品运输 样品一定要放置在有干冰或冰块的冷藏包中,保持全程冷链运输。要求在运输至实验室时,干冰仍覆盖标本或冰块仍未完全融化。
1.2 样品处理
1.2.1 抗凝血和血清处理 取抗凝血或血清200µl,置1.5ml灭菌离心管中。
1.2.2 组织样品处理 分别从待检组织三个不同的部位称取样品约1g,用手术剪剪碎混匀,再取0.05g于研磨器中研磨,加入1.5ml生理盐水继续研磨,待匀浆后转至1.5ml灭菌离心管中,8000r/min离心2分钟,取上清液200µl,置1.5ml灭菌离心管中。
1.2.3 粪便样品处理 取0.3g样品于研磨器中研磨,加入1.5ml生理盐水继续研磨,待匀浆后转至1.5ml灭菌离心管中,8000r/min离心2分钟,取上清液200µl,置1.5ml灭菌离心管中。
1.2.4 阳性对照处理 取阳性对照200µl,置1.5ml灭菌离心管中。
1.2.5 阴性对照处理 取阴性对照200µl,置1.5ml灭菌离心管中。
1.3 病毒DNA的提取
1.3.1 取已处理的样品、阴性对照和阳性对照,分别加入200µl消化液和20µl蛋白酶K,振荡混匀后,置56℃水浴中消化,每5分钟涡旋振荡一次,共消化15分钟。
1.3.2 从水浴锅中取出样品管,降至室温后,加入200μl DNA结合液,颠倒混匀,将全部液体移入吸附柱中(吸附柱要套上收集管,吸取液体时尽量不要吸到悬浮杂质,以免离心时堵塞吸附柱),室温静置3分钟,10000r/min离心30秒。
1.3.3 弃去收集管中液体,加入500μl DNA洗涤液,10000r/min离心30秒。
1.3.4 重复步骤1.3.3。
1.3.5 弃去收集管中液体,10000r/min空柱离心1分钟,以除去残留的DNA洗涤液。
1.3.6 将吸附柱放入新的1.5ml离心管中,向柱中央加入DNA洗脱液50μl,室温放置2分钟,10000r/min离心30秒,离心管中液体即为模板DNA。
1.4 实时荧光PCR操作
1.4.1 反应体系配制 设被检样品、阴性对照和阳性对照的份数总和为N,按如下反应体系配制:
|
无菌无核酸酶水 |
6.4×(N+1)µl |
|
PCR扩增反应液 |
10×(N+1)µl |
|
实时荧光混合液 |
2.6×(N+1)µl |
|
合计: |
19×(N+1)µl |
将以上配制的反应体系充分混匀后,分装至每个反应管中各19µl。分别取1.3.6中DNA 1µl,加入相应反应管中,盖紧管盖后5000r/min离心30秒。
1.4.2 扩增 将反应管放入荧光PCR仪内,记录样本摆放顺序。反应参数为95℃预变性2分钟;95℃变性5秒,58℃退火延伸15秒,共40个循环,荧光收集设置在每次循环的退火延伸结束时进行(报告基团“FAM”,淬灭基团“NONE”)。
2 判定
2.1 结果分析条件设定 阈值设定原则:阈值线超过阴性对照扩增曲线的最高点,且相交于阳性对照扩增曲线进入指数增长期的拐点,或根据仪器噪声情况进行调整。每个样品反应管内的荧光信号到达设定的阈值时所经历的循环数即为Ct值。
2.2 结果成立条件 阳性对照Ct值<30并出现特异的扩增曲线,阴性对照无Ct值且无特异的扩增曲线,试验结果成立。
2.3 结果判定
2.3.1 被检样品Ct值≤35并出现特异的扩增曲线,判为非洲猪瘟病毒核酸阳性。
2.3.2 被检样品无Ct值或Ct值≥40且无特异的扩增曲线,判为非洲猪瘟病毒核酸阴性。
2.3.3 被检样品35<Ct值<40并出现特异的扩增曲线,判为非洲猪瘟病毒核酸疑似,对疑似样品,需重新取样提取DNA,按双倍模板量(即2µl DNA)进行复检,Ct值<40并出现特异的扩增曲线判为阳性,否则判为阴性。
【注意事项】 (1)所有试剂应在规定的温度下保存。
(2)实验室应分配液区、模板提取区和扩增区。工作流程顺序为配液区→模板提取区→扩增区。各区器材试剂专用,不可跨区使用。实验结束后立即用1%次氯酸钠或75%酒精或紫外灯消毒工作台。
(3)PCR扩增反应液应置于冰盒上使用,其余冷冻保存的试剂使用前应室温融化,再8000r/min离心15秒,使液体全部沉于管底。用毕所有试剂立即放回原处。
(4)离心管、吸头等在实验前应全部高压灭菌。用灭菌的镊子夹取离心管,打开和盖上离心管盖时避免手和手套接触离心管口,若离心管开盖时有液体粘在手上或溅出,应立即更换手套。
(5)提取的样品,短期内使用放置于2~8℃或冰上,长期应在-70℃以下保存,但仍以新鲜提取的样品效果最好。
(6)反应体系在特定配液区配制,配制和分装反应体系时应尽量避免产生气泡,上机前,5000r/min离心30秒,检查各反应管是否盖紧,以免荧光物质泄露污染仪器,整个实验过程应严格控制污染。
(7)严格遵守操作说明可以获得最好的结果。操作过程中移液、定时、转速等全部参数必须精确。
(8)注意防止试剂盒组分受污染。不要使用超过有效期限的试剂,不同批次试剂盒之间的组分不要混用。
(9)所有用于检测的废弃物品均应放入含消毒液的废物缸内,高压灭菌处理。
【规格】 50份/盒
【贮藏与有效期】 蛋白酶K、无菌无核酸酶水、PCR扩增反应液、实时荧光混合液、阳性对照和阴性对照-20℃以下保存,其他组分室温保存,有效期为9个月。
附注:
1 敏感性质控品标准
1.1 ASFV/M1标准
本品系将本试剂盒的阳性对照用健康猪脾脏和淋巴结组织研磨液进行10倍稀释,定量分装后制得。
1.1.1 性状 淡黄色液体。
1.1.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
1.1.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
1.1.4 规格 200µl/管
1.1.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
1.2 ASFV/M2标准
本品系将本试剂盒的阳性对照用健康猪脾脏和淋巴结组织研磨液进行100倍稀释,定量分装后制得。
1.2.1 性状 淡黄色液体。
1.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
1.2.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
1.2.4 规格 200µl/管
1.2.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
1.3 ASFV/M3标准
本品系将本试剂盒的阳性对照用健康猪脾脏和淋巴结组织研磨液进行1000倍稀释,定量分装后制得。
1.3.1 性状 淡黄色液体。
1.3.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
1.3.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性,且35<Ct值<38。
1.3.4 规格 200µl/管
1.3.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
1.4 ASFV/M4标准
本品系用表达基因I型非洲猪瘟病毒p72基因的甘油菌接种适宜培养基培养,收获培养物,提取、酶切、纯化质粒,加入消化液混匀,定量分装后制得。
1.4.1 性状 淡黄色液体。
1.4.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
1.4.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
1.4.4 规格 200µl/管
1.4.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
1.5 ASFV/M5标准
本品系用表达基因V型非洲猪瘟病毒p72基因的甘油菌接种适宜培养基培养,收获培养物,提取、酶切、纯化质粒,加入消化液混匀,定量分装后制得。
1.5.1 性状 淡黄色液体。
1.5.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
1.5.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
1.5.4 规格 200µl/管
1.5.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
1.6 ASFV/M6标准
本品系用表达基因VIII型非洲猪瘟病毒p72基因的甘油菌接种适宜培养基培养,收获培养物,提取、酶切、纯化质粒,加入消化液混匀,定量分装后制得。
1.6.1 性状 淡黄色液体。
1.6.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
1.6.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
1.6.4 规格 200µl/管
1.6.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
1.7 ASFV/M7标准
本品系用表达基因IX型非洲猪瘟病毒p72基因的甘油菌接种适宜培养基培养,收获培养物,提取、酶切、纯化质粒,加入消化液混匀,定量分装后制得。
1.7.1 性状 淡黄色液体。
1.7.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
1.7.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
1.7.4 规格 200µl/管
1.7.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
1.8 ASFV/M8标准
本品系用表达基因X型非洲猪瘟病毒p72基因的甘油菌接种适宜培养基培养,收获培养物,提取、酶切、纯化质粒,加入消化液混匀,定量分装后制得。
1.8.1 性状 淡黄色液体。
1.8.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
1.8.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阳性。
1.8.4 规格 200µl/管
1.8.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
2 特异性质控品标准
2.1 ASFV/T1标准
本品系用生理盐水将商品化猪瘟活疫苗(每头份至少含150个兔体感染量)适当稀释,加入消化液混匀,定量分装后制得。
2.1.1 性状 淡黄色液体。
2.1.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.1.3 特异性 按国标GB/T 27540-2011《猪瘟病毒实时荧光RT-PCR检测方法》中实时荧光RT-PCR方法进行检验,应为阳性。
2.1.4 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
2.1.5 规格 200µl/管
2.1.6 贮藏与有效期 -70℃以下保存,有效期为12个月。
2.2 ASFV/T2标准
本品系用生理盐水将商品化猪繁殖与呼吸综合征病毒活疫苗(每头份病毒含量≥105.0TCID50)适当稀释,加入消化液混匀,定量分装后制得。
2.2.1 性状 淡黄色液体。
2.2.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.2.3 特异性 按国标GB/T18090-2008《猪繁殖与呼吸综合诊断方法》中RT-PCR方法进行检验,应为阳性。
2.2.4 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
2.2.5 规格 200µl/管
2.2.6 贮藏与有效期 -70℃以下保存,有效期为12个月。
2.3 ASFV/T3标准
本品系用生理盐水将商品化伪狂犬病活疫苗(每头份病毒含量≥5.0×103.0TCID50)适当稀释,加入消化液混匀,定量分装后制得。
2.3.1 性状 淡黄色液体。
2.3.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.3.3 特异性 按国标GB/T18641-2002《伪狂犬病诊断技术》中PCR方法进行检验,应为阳性。
2.3.4 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
2.3.5 规格 200µl/管
2.3.6 贮藏与有效期 -70℃以下保存,有效期为12个月。
2.4 ASFV/T4标准
本品系用商品化猪圆环病毒2型灭活疫苗(全病毒灭活前每毫升病毒含量≥107.0TCID50),加入消化液混匀,定量分装后制得。
2.4.1 性状 乳白色液体,久置分层。
2.4.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.4.3 特异性 按国标GB/T21674-2008《猪圆环病毒聚合酶链反应试验方法》中PCR方法进行检验,应为阳性。
2.4.4 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
2.4.5 规格 200µl/管
2.4.6 贮藏与有效期 -70℃以下保存,有效期为12个月。
2.5 ASFV/T5标准
本品系取健康猪脾脏组织,研磨匀浆,离心,取上清液,加入消化液混匀,定量分装制得。
2.5.1 性状 淡黄色液体。
2.5.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.5.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
2.5.4 规格 200µl/管
2.5.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
2.6 ASFV/T6标准
本品系取健康猪淋巴结组织,研磨匀浆,离心,取上清液,加入消化液混匀,定量分装制得。
2.6.1 性状 淡黄色液体。
2.6.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.6.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
2.6.4 规格 200µl/管
2.6.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
2.7 ASFV/T7标准
本品系取健康猪EDTA抗凝全血,加入消化液混匀,定量分装制得。
2.7.1 性状 黑红色液体。
2.7.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.7.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
2.7.4 规格 200µl/管
2.7.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
2.8 ASFV/T8标准
本品系取健康猪肌肉组织,研磨匀浆,离心,取上清液,加入消化液混匀,定量分装制得。
2.8.1 性状 淡黄色液体。
2.8.2 无菌检验 按现行《中国兽药典》附录进行检验,应无菌生长。
2.8.3 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
2.8.4 规格 200µl/管
2.8.5 贮藏与有效期 -70℃以下保存,有效期为12个月。
2.9 ASFV/T9标准
本品系取健康猪粪便,研磨匀浆,离心,取上清液,加入消化液混匀,定量分装制得。
2.9.1 性状 淡黄色液体。
2.9.2 效能检验 用OIE推荐的非洲猪瘟病毒实时荧光PCR方法进行检验,应为阴性。
2.9.3 规格 200µl/管
2.9.4 贮藏与有效期 -70℃以下保存,有效期为12个月。
四、鳜传染性脾肾坏死病灭活疫苗(NH0618株)质量标准
鳜传染性脾肾坏死病灭活疫苗(NH0618株)
Gui Chuanranxingpishenhuaisibing Miehuoyimiao(NH0618 Zhu)
Mandarin Infectious Spleen and Kidney Necrosis Vaccine, Inactivated(Strain NH0618)
本品系用传染性脾肾坏死病毒NH0618株接种鳜仔鱼传代细胞(MFF-1),收获细胞培养物,经甲醛溶液灭活后,加矿物油佐剂混合乳化制成。用于预防鳜传染性脾肾坏死病。
【性状】 外观 乳白色均匀乳剂。
剂型 为油包水型。取一清洁吸管,吸取少量疫苗滴于冷水表面,除第一滴外,均应不扩散。
稳定性 吸取疫苗10ml加入离心管中,以3000r/min离心15分钟,管底析出水相应不超过0.5ml。
黏度 按现行《中国兽药典》附录进行检验,应符合规定。
【装量检查】 按现行《中国兽药典》附录进行检验,应符合规定。
【无菌检验】 按现行《中国兽药典》附录进行检验,应无菌生长。
【安全检验】 将体重20~40g健康鳜(附注1,下同)在水温25~28℃循环水饲养7日以上。随机取100尾,分为2组,每组50尾,一组为免疫组,另一组为对照组,停止喂饲24小时后进行注射。免疫组经腹腔注射疫苗,每尾0.2ml;对照组经腹腔注射生理盐水,每尾0.2ml。采用水温25~28℃循环水分箱饲养,连续观察14日,免疫组和对照组应全部健活(附注2,下同),若有非特异性死亡(附注3),每组应不超过3尾。
【效力检验】 将体重20~40g健康鳜在水温25~28℃循环水饲养7日以上。随机取120尾,分成2组,每组60尾,一组为免疫组,另一组为对照组,停止喂饲24小时后进行注射。免疫组经腹腔注射疫苗,每尾0.1ml;对照组经腹腔注射生理盐水,每尾0.1ml。采用水温25~28℃循环水分箱饲养21日后,免疫组和对照组各取50尾进行攻毒,攻毒前停止喂饲24小时,经背部肌肉注射NH0618株病毒液(含106.0TCID50/ml),每尾0.1ml。采用水温25~28℃循环水分箱饲养,连续观察14日,免疫组应至少45尾健活,对照组应至少45尾死亡(附注4)。
【甲醛残留量测定】 按现行《中国兽药典》附录进行测定,应符合规定。
【作用与用途】 用于预防鳜传染性脾肾坏死病。免疫期为6个月。
【用法与用量】 腹腔注射。20g以上的鳜每尾注射0.1ml。
【注意事项】 (1)仅用于接种健康鳜。
(2)疫苗贮藏及运输过程中切勿冻结,启封后应在4小时内用完,长时间暴露在高温下会影响疫苗效力,使用前使疫苗恢复至室温并充分摇匀。
(3)使用前应仔细检查包装,如发现破损、残缺、文字模糊、过期失效等,则禁止使用。
(4)禁止与其他疫苗合用。
(5)疫苗使用前,鱼应停止喂饲24小时。注射接种时,建议戴上棉布手套抓鱼并轻拿轻放,尽量避免因操作不当造成鱼的损伤。接种时应避开阴雨闷热天气,以防止供氧不足造成鱼的死亡。
(6)应使用无菌的注射器。
(7)如意外将疫苗污染到人的眼、鼻、口中或注射到人体内时,应及时对患部采取消毒等措施。必要时,请医疗人员予以治疗。
(8)用过的疫苗瓶、器具和未用完的疫苗等应进行无害化处理。
【规格】 (1)20ml/瓶 (2)50ml/瓶 (3)100ml/瓶 (4)250ml/瓶 (5)500ml/瓶
【贮藏与有效期】 2~8℃保存,有效期为12个月。
附注:
1 健康鳜的判定标准 符合以下所有特征者,判定为健康鳜。
1.1 头部、吻部、鳃盖、鳍条等部位均无充血。
1.2 肥满度均匀,无畸形,体表完好,有光泽,无擦痕,无掉鳞。
1.3 鳃丝整齐完好、色泽鲜红、无异物。
1.4 体表和鳃无寄生虫和霉菌感染。
1.5 摄食正常。
1.6 鱼群多聚集在箱底,对外界惊扰反应灵敏。
1.7 根据鱼群大小,随机抽取一定数量鳜(100尾以下的鱼群随机抽取5尾,100~500尾的鱼群随机抽取10尾,500尾以上的鱼群随机抽取20尾),取脾脏采用PCR方法检测传染性脾肾坏死病毒(见附注5)、鳜蛙病毒(见附注6)和鳜弹状病毒(见附注7),结果应均为阴性。
2 健活鳜的判定标准 符合以下所有特征者,判定为健活鳜。
3.1 体表完好,有光泽。
3.2 摄食正常。
3.3 鱼群多聚集在箱底,对外界惊扰反应灵敏。
3 非特异性死亡鳜的判定标准 除特异性死亡外,其他的死亡均判定为非特异性死亡。
4 特异性死亡鳜判定标准 符合以下全部特征者,判为特异性死亡。
4.1 攻毒72小时后死亡。
4.2 体表完好、无光泽,体色变黑。
4.3 鳃丝整齐完好、鳃褪色。
4.4 解剖后,脾脏、肾脏肿大,呈暗红色。
5 传染性脾肾坏死病毒PCR检测方法
5.1 引物
上游引物 5’-TCATTGTCATCATCATGTCTGC-3’;
下游引物 5’- AGACACACGGGGCAATC-3’;
预期扩增片段大小为1399bp。
5.2 样品处理
5.2.1 待检样品 取脾脏按1︰9(w/v)加入PBS(0.01mol/L,pH值7.2),冰浴后匀浆,3000r/min4℃离心10分钟,取上清200μl。
5.2.2 阳性对照 取传染性脾肾坏死病毒阳性病毒液200μl。
5.2.3 阴性对照 取PBS(0.01mol/L,pH值7.2)200μl。
5.2.4 DNA提取 取待检样品、阳性对照和阴性对照,按照DNA提取试剂盒的说明书进行DNA提取。
5.3 PCR反应
反应体系 10×PCR Buffer 2.5μl,dNTPs 2.0μl,上、下游引物各1.0 μl,Taq酶0.5μl, DNA模板1.0μl,加双蒸水至25μl体系。
反应程序 94℃预变性3分钟;94℃变性60秒,58℃退火60秒,72℃延伸60秒,共30个循环;72℃延伸7分钟。
5.4 电泳 PCR扩增产物按1︰9加入10×上样缓冲液后,取10μl使用浓度为1%的琼脂糖凝胶进行电泳。120V电泳20min后在波长为254nm或312nm的紫外灯下观察。
5.5 结果判定 阳性对照出现1399bp电泳条带,阴性对照无扩增条带,试验成立。出现1399bp扩增条带的样品为传染性脾肾坏死病毒阳性。
6 鳜蛙病毒PCR检测方法
6.1 引物
上游引物 5’-GGAATTCATGTCTTCTGTAACTGGTTCAG-3’;
下游引物 5’-CCGCTCGAGTTACAAGATTGGGAATCCCATCGAG-3’;
预期扩增片段大小为1392bp。
6.2 样品处理
6.2.1 待检样品 取脾脏按1︰9(w/v)加入PBS(0.01mol/L,pH值7.2),冰浴后匀浆,3000r/min4℃离心10分钟,取上清200μl。
6.2.2 阳性对照 取鳜蛙病毒阳性病毒液200μl。
6.2.3 阴性对照 取PBS(0.01mol/L,pH值7.2)200μl。
6.2.4 DNA提取 取待检样品、阳性对照和阴性对照,按照DNA提取试剂盒的说明书进行DNA提取。
6.3 PCR反应
反应体系 10×PCR Buffer 2.5μl,dNTPs 2.0μl,上、下游引物各1.0 μl,Taq 酶0.5μl,DNA模板1.0μl,加双蒸水至25μl。
反应程序 94℃预变性3分钟;94℃变性30秒,52℃退火30秒,72℃延伸60秒,共30个循环;72℃延伸7分钟。
6.4 电泳 PCR扩增产物按1︰9加入10×上样缓冲液后,取10μl使用浓度为1%的琼脂糖凝胶进行电泳。120V电泳20min后在波长为254nm或312nm的紫外灯下观察。
6.5 结果判定 阳性对照出现1392bp电泳条带,阴性对照无扩增条带,试验成立。出现1392bp扩增条带的样品为鳜蛙病毒阳性。
7 鳜弹状病毒RT-PCR检测方法
7.1 引物
上游引物 5’- CGTGGTCCGCTATCTCTGT-3’;
下游引物 5’- AGTGTTGCCTCCGATGTCA-3’;
预期扩增片段大小为850bp。
7.2 样品处理
7.2.1 待检样品 取脾脏按1︰9(w/v)加入PBS(0.01mol/L,pH值7.2),冰浴后匀浆,3000r/min4℃离心10分钟,取上清200μl。
7.2.2 阳性对照 取鳜弹状病毒阳性病毒液200μl。
7.2.3 阴性对照 取PBS(0.01mol/L,pH值7.2)200μl。
7.2.4 RNA提取 取待检样品、阳性对照和阴性对照,按照DNA提取试剂盒的说明书进行RNA提取。
7.3 RT-PCR反应
反应体系 2×RT-PCR预混液12.5μl,上、下游引物各1.0 μl,RNA模板2.0μl,加无RNA酶水至25μl。
反应程序 50℃反转录30分钟;94℃预变性3分钟;94℃变性30秒,55℃退火30秒,72℃延伸60秒,共30个循环;72℃延伸7分钟。
7.4 电泳 RT-PCR扩增产物按1︰9加入10×上样缓冲液后,取10μl使用浓度为1%的琼脂糖凝胶进行电泳。120V电泳20min后在波长为254nm或312nm的紫外灯下观察。
7.5 结果判定 阳性对照出现850bp电泳条带,阴性对照无扩增条带,试验成立。出现850bp扩增条带的样品为鳜弹状病毒阳性。
五、七味消滞颗粒质量标准
七味消滞颗粒
Qiwei Xiaozhi Keli
【处方】 薏苡仁893g 稻芽893g 山楂446g 淡竹叶670g
钩藤335g 蝉蜕112g 甘草112g
【制法】 以上7味,薏苡仁、稻芽加水煎煮二次,每次2小时,煎液滤过,滤液合并,浓缩至相对密度1.08~1.12(55℃),加入乙醇使含醇量达45%,静置,滤过,滤液回收乙醇并浓缩成稠膏;其余山楂等5味加水煎煮二次,每次2 小时,煎液滤过,滤液合并,浓缩至适量,与上述稠膏合并,加入适量蔗糖,制成颗粒,干燥,制成1000g,即得。
【性状】 本品为黄棕色至红棕色的颗粒;气微,味甜、微苦。
【鉴别】 (1)取本品5g,加水20ml使溶化,置分液漏斗中,加乙酸乙酯振摇提取2次,每次15ml,合并乙酸乙酯液,水浴蒸干,残渣加乙酸乙酯1ml使溶解,作为供试品溶液。另取薏苡仁对照药材1g,加乙酸乙酯30ml,超声处理30分钟,滤过,滤液蒸干,残渣加乙酸乙酯1ml使溶解,作为对照药材溶液。照薄层色谱法(附录0502)试验,吸取上述两种溶液各10μl,分别点于同一硅胶G薄层板上,以石油醚(60~90℃)-乙醚-冰醋酸(83︰17︰0.5)为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。
(2)取本品7g,置研钵中,加2%盐酸乙醇溶液20ml,研细,转移至锥形瓶中,浸渍30分钟,时时振摇,滤过,滤液蒸干,用无水乙醇约5ml清洗残渣,将清洗液及残渣转移至离心试管中,离心,取上清液,挥散至1ml,作为供试品溶液。另取山楂对照药材1g,加2%盐酸乙醇溶液20ml,超声处理30分钟,滤过,自“滤液蒸干”起,同法制成对照药材溶液。照薄层色谱法(附录0502)试验,吸取上述两种溶液各6μl,分别点于同一硅胶G薄层板上,以乙醚-三氯甲烷-甲酸(5︰5︰1)为展开剂,将薄层板在展开缸中预平衡15分钟,展开,取出,晾干,在105℃加热15分钟,趁热喷以溴酚蓝指示液。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。
(3)取本品7g,加水20ml,温热使溶解,用乙酸乙酯振摇提取2次,每次10ml,合并乙酸乙酯液,蒸干,残渣加无水乙醇1ml使溶解,作为供试品溶液。另取甘草对照药材0.2g,加乙醚20ml,超声处理30分钟,滤过,弃去滤液,药渣加甲醇10ml,超声处理30分钟,滤过,滤液蒸干,残渣用水10ml溶解,自“用乙酸乙酯振摇提取2次”起,同法制成对照药材溶液。照薄层色谱法(附录0502)试验,吸取上述两种溶液各4μl,分别点于同一用1%氢氧化钠溶液制备的硅胶G薄层板上,以乙酸乙酯-甲酸-冰醋酸-水(15︰1︰1︰1)为展开剂,将薄层板在展开缸中预平衡15分钟,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置紫外光灯(365nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。
(4)取本品10g,加水30ml,温热使溶解,用浓氨试液调节pH值至9,用乙醚振摇提取3次,每次25ml,合并乙醚液,挥干,残渣加无水乙醇1ml使溶解,作为供试品溶液。另取钩藤对照药材1g,加浓氨试液1ml润湿,加三氯甲烷20ml,超声处理20分钟,滤过,滤液用3%硫酸溶液振摇提取3次,每次20ml,合并酸液,用浓氨试液调节pH值至9~10,再用三氯甲烷振摇提取3次,每次20ml,合并三氯甲烷液,蒸干,残渣加无水乙醇1ml使溶解,作为对照药材溶液。照薄层色谱法(附录0502)试验,吸取上述两种溶液各15μl,分别点于同一硅胶GF254薄层板上,以石油醚(60~90℃)-丙酮(6︰4)为展开剂,置氨蒸气饱和的展开缸内,预平衡15分钟,展开,取出,晾干。置紫外光灯(254nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。
【检查】 应符合颗粒剂项下有关的各项规定(附录0106)。
【含量测定】 照高效液相色谱法(附录0512)测定。
色谱条件与系统适用性试验 以十八烷基硅烷键合硅胶为填充剂;以甲醇-0.2mol/L醋酸铵溶液-冰醋酸(65︰35︰1)为流动相;检测波长为250nm。理论板数按甘草酸峰计算应不低于2000。
对照品溶液的制备 取甘草酸铵对照品适量,精密称定,加流动相制成每1ml含16μg的溶液,即得(甘草酸重量=甘草酸铵重量/1.0207)。
供试品溶液的制备 取本品适量,混匀,研细,取约0.7g,精密称定,置50ml量瓶中,加流动相约45ml,超声处理(功率300W,频率40kHz)30分钟,放冷,加流动相至刻度,摇匀,滤过,取续滤液,即得。
测定法 精密吸取对照品溶液与供试品溶液各20μl,注入液相色谱仪,测定,即得。
本品每1g含甘草以甘草酸(C42H62O16)计,应不少于0.70mg。
【功能】 开胃消滞,清热定惊。
【主治】 仔猪积滞化热。证见少食懒动,鼻盘干燥,粪便酸臭或燥结等。
【用法与用量】 混饲:每1kg饲料,仔猪4g,连用 3日。
【规格】 每1g相当于原生药3.461g。
【贮藏】 密封。
【有效期】 24个月。
【生产企业】
六、复方过硫酸氢钾枸橼酸粉质量标准
复方过硫酸氢钾枸橼酸粉
Fufang Guoliusuanqingjia Juyuansuan Fen
Compound Potassium Peroxymonosulphate and Citric Acid Powder
本品由过硫酸氢钾复合盐(2KHSO5·KHSO4·K2SO4)、枸橼酸、十二烷基苯磺酸钠、氯化钾等配制而成。含有效氯不得少于10.0%,枸橼酸(C6H8O7)应为标示量的90.0%~110.0% 。
【性状】 本品为淡粉红色至淡紫红色粉末或颗粒,有柠檬气味。
【鉴别】 (1)十二烷基苯磺酸钠 取本品200mg,加甲醇10ml,充分振摇,静置,取上清液作为供试品溶液;另取十二烷基苯磺酸钠适量,加甲醇制成每1ml中含有2.0mg的溶液,作为对照品溶液;取十二烷基苯磺酸钠和十二烷基硫酸钠各10mg,加甲醇10ml使溶解,作为系统适用性溶液(1);取十二烷基苯磺酸钠和十二烷基磺酸钠各10mg,加甲醇10ml使溶解,作为系统适用性溶液(2)。照薄层色谱法(附录0502)试验,吸取上述四种溶液各5μl,分别点于同一块硅胶G薄层板上,以二氧六环-硝基甲烷-氨试液(50︰30︰5)为展开剂,展开,取出,晾干,喷以0.04%溴酚蓝乙醇溶液。系统适用性溶液(1)和(2)各应显两个完全分离的斑点;供试品溶液所显主斑点的位置应与对照品溶液的主斑点相同,其颜色不得更浅。
(2)枸橼酸 在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】 溶解性 取本品0.5g,加水50ml,充分搅拌,应全部溶解。
pH值 取溶解性项下的溶液,依法测定(附录0631),pH值应为1.50~2.50。
氯化钾 取本品约5.0g,精密称定,置250ml烧杯中,加水200ml溶解后,立即照电位滴定法(附录0701),用硝酸银滴定液(0.1mol/L)滴定。每1ml硝酸银滴定液(0.1mol/L)相当于7.455mg的氯化钾,氯化钾含量应不低于2.0%。
其他 应符合粉剂项下有关的各项规定(附录0108)
【含量测定】 枸橼酸 照高效液相色谱法(附录0512)测定
色谱条件及系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;以甲醇-0.1%磷酸溶液(5︰95)为流动相;检测波长为210nm。理论板数按枸橼酸峰计算,应不低于5000。
测定法 取本品约10.0g,精密称定,置1000ml量瓶中,加水适量,振摇使溶解并稀释至刻度,摇匀,精密量取5ml,置25ml量瓶中,加水稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;另取枸橼酸对照品适量,精密称定,加水制成每1ml含0.3mg的溶液,作为对照品溶液。分别精密量取供试品溶液与对照品溶液各10µl,注入液相色谱仪,记录色谱图。按外标法以峰面积计算,即得。
有效氯 取本品约10.0g,精密称定,置1000ml量瓶中,加水适量,振摇使溶解并稀释至刻度,精密量取100ml,置250ml碘量瓶中,加10%醋酸溶液10ml和碘化钾1g,振摇使溶解。用硫代硫酸钠滴定液(0.1mol/L)滴定至近终点时,加淀粉指示液2ml,继续滴定至溶液变成原来的颜色,并将滴定结果用空白试验校正。每1ml的硫代硫酸钠滴定液(0.1mol/L)相当于3.545mg 的Cl。
【作用与用途】 消毒防腐药。用于畜禽厩舍、空气、饮用水等的消毒。
【用法与用量】 以本品计。浸泡或喷雾:畜舍环境消毒、空气消毒,1︰200倍稀释;饮用水消毒,1︰1000倍稀释;对特定病原体消毒,大肠杆菌1︰400倍稀释,禽流感病毒1︰3200倍稀释,新城疫病毒1︰6400倍稀释,猪瘟病毒、猪蓝耳病病毒1︰800倍稀释。
【不良反应】 按推荐的用法与用量使用,未见不良反应。
【注意事项】 1.现配现用。
2.不与碱类物质混存或合并使用。
3.产品用尽后,包装不得乱丢弃。
【休药期】 不需要制定。
【规格】 枸橼酸15.0%,含有效氯不得少于10.0%。
【包装】
【贮藏】 密闭,在干燥处保存。
【有效期】 24个月。
【生产企业】
七、氨基丁三醇前列腺素F2α注射液质量标准
氨基丁三醇前列腺素F2α注射液
Anji Dingsanchun Qianliexiansu F2α Zhusheye
Prostaglandin F2α Tromethamine Injection
本品为氨基丁三醇前列腺素F2α和适量苯甲醇制成的无菌水溶液。含前列腺素F2α(C20H34O5)应为标示量的90.0%~110.0%。
【性状】 本品为无色的澄明液体。
【鉴别】 在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】 pH值 应为7.0~9.0(《中国兽药典》附录0631)。
有关物质 取本品适量,用水-乙腈(65∶35)稀释制成每1ml中约含前列腺素F2α 0.75mg的溶液,作为供试品溶液;精密量取适量,用水-乙腈(65∶35)稀释制成每1ml中约含前列腺素F2α 15μg的溶液,作为对照溶液;另取氨基丁三醇前列腺素F2α对照品约10mg,置10ml量瓶中,加流动相稀释至刻度,将该溶液置于85℃水浴中加热8分钟(使氨基丁三醇前列腺素F2α降解产生杂质B),冷却至室温,作为系统适用性溶液。照含量测定项下的色谱条件,取系统适用性溶液10µl注入液相色谱仪,记录色谱图。理论板数按前列腺素F2α峰计算应不低于6000,杂质A和杂质B与前列腺素F2α峰的分离度分别不小于1.5和1.0。再精密量取供试品溶液与对照溶液各10μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。供试品溶液色谱图中如有杂质峰(扣除相对保留时间小于0.3的色谱峰及相对保留时间约为0.45的苯甲醇峰),杂质A(相对保留时间0.94)峰面积不得大于对照溶液主峰面积(2.0%),杂质B(相对保留时间1.05)峰面积不得大于对照溶液主峰面积的0.75倍(1.5%),各杂质峰面积之和不得大于对照溶液主峰面积的2.5倍(5.0%)。
苯甲醇 精密量取本品适量,用水-乙腈(65∶35)稀释制成每1ml中约含前列腺素F2α 0.75mg的溶液,作为供试品溶液;精密称取苯甲醇对照品适量,用水-乙腈(65∶35)稀释制成每1ml中约含苯甲醇1.0mg的溶液,作为对照品溶液。按照高效液相色谱法(《中国兽药典》附录0512)测定,用十八烷基硅烷键合硅胶为填充剂;以水-乙腈-磷酸(650∶350∶1)为流动相;检测波长为258nm。苯甲醇与相邻峰的分离度应符合规定。精密量取供试品溶液与对照品溶液各10µl,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算,每1ml本品中含苯甲醇应为8.0mg~12.0mg。
无菌 取本品经薄膜过滤法处理,依法检查(《中国兽药典》附录1101),应符合规定。
其他 应符合注射剂项下有关的各项规定(《中国兽药典》附录0102)。
【含量测定】 按照高效液相色谱法(《中国兽药典》附录0512)测定。
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂(Diamonsil C18 4.6mm×250mm, 5μm或效能相当的色谱柱);以水-乙腈-磷酸(650∶350∶1)为流动相;检测波长为200nm,流速为每分钟1.5ml。取有关物质项下的系统适用性溶液10µl注入液相色谱仪,记录色谱图。理论板数按前列腺素F2α峰计算应不低于6000,相邻峰与前列腺素F2α峰的分离度应大于1.0。
测定法 精密量取本品3ml,置20ml量瓶中,用水-乙腈(65∶35)稀释制成每1ml中约含前列腺素F2α 0.75mg的溶液,作为供试品溶液。精密量取10µl注入液相色谱仪,记录色谱图。另取氨基丁三醇前列腺素F2α对照品适量,精密称定,用水-乙腈(65∶35)溶解并稀释制成每1ml中约含氨基丁三醇前列腺素F2α 1mg的溶液,同法测定。按外标法以峰面积计算,将计算结果乘以0.7453,即得。
【作用与用途】 前列腺素类药。有溶解黄体作用,主要用于控制母牛同期发情。
【用法与用量】 以前列腺素F2α计。肌内注射:一次量,牛25mg(5ml)。
【不良反应】 按推荐剂量使用未见不良反应。
【注意事项】 1.避免怀孕妇女接触药液,禁止患气管、支气管或其他呼吸道疾病患者或怀孕妇女对动物注射本品。
2.本品滴在皮肤上,应立即用肥皂和水清洗。
3.患急性或亚急性血管、胃肠道及呼吸系统疾病的动物禁用。
4.本品能导致多种动物流产或诱导分娩,注射本品前必须确定妊娠状态。
5.排卵后五天内给药无效。
6.禁止静脉注射。
【休药期】 牛1日。
【规格】 (1)10ml∶前列腺素F2α 50mg (2)20ml∶前列腺素F2α 100mg (3)50ml∶前列腺素F2α 250mg
【包装】 安瓿瓶、西林瓶
【贮藏】 密闭,在凉暗处保存。
【有效期】 24个月。开启后24小时内有效。
【生产企业】 宁波三生生物科技有限公司。
杂质A
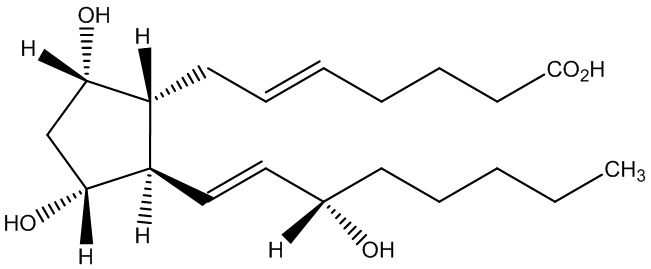
图1-1 杂质A的结构式
杂质A的中文命名: (E)-7-[(1R,2R,3R,5S)-3,5-二羟基-2-[(S,E)-3-羟基辛-1-烯基]环戊基]庚-5-烯酸
英文简称:5,6-trans isomer (5,6-trans 异构体)
杂质B
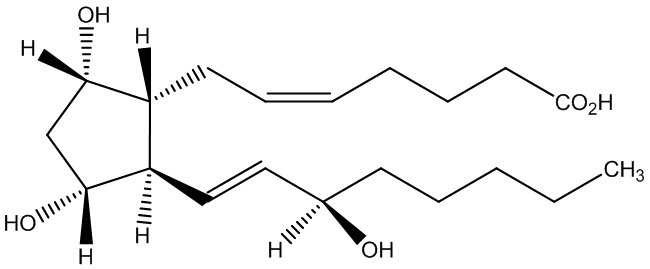
图1-2 杂质B的结构式
杂质B的中文命名:(Z)-7-[(1R,2R,3R,5S)-3,5-二羟基-2-[(R,E)-3-羟基辛-1-烯基]环戊基]庚-5-烯酸
英文简称:15-R isomer (15-R 异构体)
八、维他昔布咀嚼片质量标准
维他昔布咀嚼片
Weitaxibu Jujuepian
Vitacoxib Chewable Tablets
本品含维他昔布(C16H14ClN3O2S)应为标示量的90.0%~110.0%。
【性状】 本品为白色刻痕片。
【鉴别】 (1)取本品的细粉适量,用甲醇溶解并稀释制成每1ml中含维他昔布10μg的溶液,照紫外-可见分光光度法(附录0401)测定,在244nm的波长处有最大吸收。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】 有关物质 取含量测定项下的细粉适量(约相当于维他昔布5mg),精密称定,置10ml量瓶中,加甲醇8ml,超声处理20分钟,放冷,用甲醇稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;精密量取1ml,至100ml量瓶中,用甲醇稀释至刻度,摇匀,作为对照溶液。照含量测定项下的色谱条件试验,精密量取供试品溶液和对照溶液各10μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。供试品溶液的色谱图中如有杂质峰,除溶剂峰外,单一杂质峰面积不得大于对照溶液主峰的面积的0.5倍(0.5%),各杂质峰面积的总和不得大于对照溶液主峰面积(1.0%)。
含量均匀度 (8mg规格)取本品1片,置200ml量瓶中,加甲醇100ml,超声使维他昔布溶解,用甲醇稀释至刻度,摇匀,过滤,取续滤液作为供试品溶液;另取维他昔布对照品适量,精密称定,用甲醇稀释并定量制成每1ml含维他昔布40μg的溶液,作为对照品溶液。照含量测定项下的方法测定含量,应符合规定(附录0941)。
溶出度 取本品,照溶出度测定法(附录0931第二法),以0.8%十二烷基硫酸钠溶液900ml为溶出介质,转速为每分钟50转,依法操作,经30分钟时,取溶液10ml,滤过,取续滤液作为供试品溶液(8mg规格),或精密量取续滤液5ml,置10ml量瓶中,用0.8%十二烷基硫酸钠溶液稀释至刻度,摇匀,作为供试品溶液(20mg规格),或精密量取续滤液3ml,置10ml量瓶中,用0.8%十二烷基硫酸钠溶液稀释至刻度,摇匀,作为供试品溶液(30mg规格)。精密称取维他昔布对照品适量,用甲醇溶解并定量稀释制成每1ml含维他昔布0.25mg的对照品储备液,精密量取对照品储备液适量,用0.8%十二烷基硫酸钠溶液定量稀释制成每1ml含维他昔布10μg的溶液,作为对照品溶液。取上述两种溶液,照紫外-可见分光光度法(附录0401),在247nm的波长处分别测定吸光度,计算出每片的溶出量。限度为标示量的70%,应符合规定。
其他 应符合片剂项下有关的各项规定(附录0101)。
【含量测定】 照高效液相色谱法(附录0512)测定。
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;以乙腈-水(37︰63)为流动相;检测波长为244nm。理论板数按维他昔布峰计算不低于3000,维他昔布峰与相邻杂质峰的分离度应符合要求。
测定法 取本品20片,精密称定,研细,精密称取细粉适量(约相当于维他昔布10mg),置25ml量瓶中,加甲醇适量,超声处理20分钟,使维他昔布溶解,用甲醇稀释至刻度,摇匀,精密量取1ml置10ml量瓶中,用甲醇稀释至刻度,摇匀,滤过,精密量取续滤液10μl,注入液相色谱仪,记录色谱图;另取维他昔布对照品适量,精密称定,加甲醇稀释并定量制成每1ml中约含维他昔布40μg的溶液,同法测定。按外标法以峰面积计算,即得。
【作用与用途】 解热镇痛抗炎药。用于治疗犬、猫围手术期及临床手术等引起的炎症和疼痛。
【用法与用量】 以维他昔布计。内服:每1kg体重,犬2mg,每日一次。建议饲喂食物后给药,术前及术后可连续给药7日。具体推荐使用剂量见下表:
犬的推荐使用剂量表
|
犬体重(kg) |
8mg片 |
20mg片 |
30mg片 |
|||
|
片数 |
剂量(mg) |
片数 |
剂量(mg) |
片数 |
剂量(mg) |
|
|
>2~2.5 |
0.5 |
4 |
|
|
|
|
|
>2.5~4 |
1 |
8 |
|
|
|
|
|
>4~6 |
1.5 |
12 |
|
|
|
|
|
>6~8 |
2 |
16 |
|
|
|
|
|
>5~10 |
|
|
1 |
20 |
|
|
|
>10~15 |
|
|
1.5 |
30 |
|
|
|
>15~20 |
|
|
2 |
40 |
|
|
|
>4~7.5 |
|
|
|
|
0.5 |
15 |
|
>7.5~15 |
|
|
|
|
1 |
30 |
|
>15~22.5 |
|
|
|
|
1.5 |
45 |
|
>22.5~30 |
|
|
|
|
2 |
60 |
|
>30~37.5 |
|
|
|
|
2.5 |
75 |
|
>37.5~45 |
|
|
|
|
3 |
90 |
内服:每1kg体重,猫1mg,每日一次。术前及术后可连续给药3日。具体推荐使用剂量见下表:
猫的推荐使用剂量表
|
猫体重(kg) |
8mg片 |
|
|
片数 |
剂量(mg) |
|
|
>2~4 |
0.5 |
4 |
|
>4~8 |
1 |
8 |
|
>8~12 |
1.5 |
12 |
【不良反应】 按推荐的用法用量使用,尚未见不良反应。
【注意事项】 1.对本品活性成分维他昔布有过敏史的动物禁用。
2.由于非甾体类抗炎药(NSAIDs)具有潜在发生胃溃疡和/或穿孔的风险,因此在使用本品时应当避免使用其它抗炎类药物,如NSAIDs或皮质类固醇类药。
3.本品对患有胃肠道出血、血液病或其它出血性疾病的犬、猫禁用。
4.如果患病犬、猫之前对NSAIDs不耐受,应在兽医的严格监测下使用本品。如果观察到下列症状应停止用药:反复腹泻、呕吐、粪便隐血、体重突然下降、厌食、嗜睡、肾或肝功能退化。
5.繁殖、妊娠或泌乳雌犬、猫,幼犬(例如10周龄以下或体重小于4公斤的犬)、幼猫(例如6周龄以下或体重小于2公斤的猫)或疑似和确诊有肾、心脏或肝功能损害的犬、猫,应在兽医的指导下使用。
6.宠物主人应该警惕诸如厌食、精神萎靡、无力等症状和体征,而且当有上述任何症状或体征发生后应该马上寻求兽医帮助。
【休药期】 无需制定
【规格】 犬用 (1)8mg (2)20mg (3)30mg
猫用 8mg
【包装】
【贮藏】 密封,干燥保存。
【有效期】 36个月。
【生产企业】
附件4
鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)等8种兽药产品说明书和标签
一、鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)说明书和内包装标签
(一)鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)说明书
兽用
鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)
【兽药名称】
通用名 鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)
商品名 无
英文名 Coryza(Serotype A,Serotype C)Vaccine,Inactivated(Strain YT+Strain JN)
汉语拼音 Jichuanranxingbiyan(A Xing,C Xing)Erjia Miehuoyimiao(YT Zhu+ JN Zhu)
【主要成分与含量】 每毫升疫苗中含灭活的副鸡禽杆菌A型YT株和C型JN株均为2.0×109CFU。
【性状】 静置后,上层为澄清液体,下层为灰白色沉淀,振摇后呈均匀混悬液。
【作用与用途】 用于预防由A型和C型副鸡禽杆菌引起的鸡传染性鼻炎。一次免疫,免疫期为4个月,二次免疫,免疫期为9个月。
【用法与用量】 颈背部皮下注射。4周龄以上鸡,每只0.5ml;建议首免后3个月加强免疫1次,每只0.5ml。
【不良反应】 一般无可见的不良反应。
【注意事项】 (1)仅适用于接种健康鸡。
(2)疫苗启封后,限当日用完。
(3)切忌冻结,使用前应将疫苗温度恢复至室温,使用时应充分摇匀。
(4)注射器具应严格消毒,接种时注射部位应进行局部消毒处理。
(5)用过的疫苗瓶、注射器和未用完的疫苗等应进行无害化处理。
【规格】 (1)20ml/瓶 (2)100ml/瓶 (3)250ml/瓶 (4)500ml/瓶
【包装】 (1)400瓶/箱 (2)80瓶/箱 (3)40瓶/箱 (4)20瓶/箱
【贮藏与有效期】 2~8℃保存,有效期为15个月。
【批准文号】
【生产企业】
仅在兽医指导下使用
(二)鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)内包装标签
兽用
鸡传染性鼻炎(A型、C型)二价灭活疫苗(YT株+JN株)
20(100、250、500)ml/瓶批准文号:
批号:
有效期至:
【作用与用途】 用于预防由A型和C型副鸡禽杆菌引起的鸡传染性鼻炎。一次免疫,免疫期为4个月,二次免疫,免疫期为9个月。
【用法与用量】 颈背部皮下注射。4周龄以上鸡,每只0.5ml;建议初免后3个月加强免疫1次,每只0.5ml。
【贮藏与有效期】 2~8℃保存,有效期为15个月。
【生产企业】
仅在兽医指导下使用
二、非洲猪瘟病毒荧光等温扩增检测试剂盒说明书和内包装标签
(一)非洲猪瘟病毒荧光等温扩增检测试剂盒说明书
兽用
【兽药名称】
通用名称:非洲猪瘟病毒荧光等温扩增检测试剂盒
汉语拼音:Feizhou Zhuwenbingdu Yingguang Dengwenkuozeng Jiance Shijihe
英 文 名 称 : African Swine Fever Virus Real-time isothermal amplification
Detection Kit
商品名称:无
【主要成分与含量】
|
组 份 |
规 格 |
|
荧光等温扩增反应液 |
1100 μl/管 x1 管 |
|
Bst DNA 聚合酶 |
50 μl /管 x1 管 |
|
阴性对照 |
1000 μl/管 x1 管 |
|
阳性对照 |
200 μl/管 x1 管 |
|
矿物油 |
1000 μl/管 x1 管 |
|
说明书 |
1 份 |
【作用与用途】 用于血液、血球粉、淋巴结、脾脏、扁桃体、肌肉中非洲猪瘟病毒核酸的检测。
【用法与判定】
1 用法
1.1 样品处理 血液样品:用双蒸水作1︰5稀释后备用;淋巴结、脾脏、扁桃体、肌肉样品,用无菌的剪刀和镊子剪取待检样品2.0 g于研钵中充分研磨,再加10.0 ml PBS(pH 7.2,含1万单位青霉素和1万单位链霉素)混匀(样品不足2.0g 按1︰5比例加 PBS),3 000 r/min,4 ℃离心5分钟,取上清液,编号备用;血球粉处理同上,只不过省掉研磨步骤。
1.2 样品存放 采集或处理好的样品在2℃~8℃条件下保存应不超过 24小时;若需长期保存,须放置-80℃冰箱,但应避免反复冻融(冻融不超过3次)。
1.3 操作步骤
(1)反应预混液的配制 按照下表配制反应预混液(注:配制和分装反应预混液时应在冰盒上进行)。按照n+2 管配制(n = 样品数)。
反应预混液的配制
|
序号 |
组份 |
1头份样品的量(μl) |
(n+2)头份样品的量(μl) |
|
1 |
荧光等温扩增反应液 |
22 |
22×(n+2) |
|
2 |
Bst DNA聚合酶 |
1.0 |
1.0 ×(n+2) |
(2)反应预混液分装 取n+2个0.2ml PCR管,将配制的反应预混液涡旋混匀,瞬时离心后,按每管23μl分装于PCR管内。
(3)每管加入20μl矿物油。
(4)加样 向对应的PCR管底部加入上述处理的样品2.0μl。同时,向阳性对照管内加入 2.0μl阳性对照,向阴性对照管内加入2.0μl DEPC水。盖紧管盖,瞬时离心,转移至检测区。
(5) 检测 将离心后的PCR管放入检测仪内(专用配套仪器或普通的荧光PCR仪均可),设定好被检样品(S)、阳性对照(PC)、阴性对照(NC)的位置。
反应参数设置:采用 64℃ 60分钟,每1分钟采集一次FAM通道荧光信号,共采集 60次。
2 判定
2.1 结果分析条件的设定 阈值设定原则:根据仪器噪声情况进行调整,以阈值线刚好超过阴性对照品扩增曲线的最高点为准。
2.2 质控标准
2.2.1 阴性对照无 Tt 值并且无扩增曲线即S型扩增曲线。
2.2.2 阳性对照的 Tt 值应小于或等于45,并出现典型的扩增曲线。
2.2.3 如阴性和阳性对照不满足以上条件,此次实验视为无效。
2.3 结果判定
1.4.1 阴性:无Tt值,且无特征性扩增曲线,表明样品为阴性。
1.4.2 阳性:Tt 值≤45,且出现典型的扩增曲线,表示样品为阳性。
1.4.3 Tt 值>45,且出现典型的扩增曲线的样品建议复验,复验仍出现上述结果的,判为阳性,否则判为阴性。
1.4.4 出现T t值但无特征性扩增曲线的样品,判定为阴性。
【注意事项】
(1)实验前请仔细阅读本试剂盒说明书,请严格按照操作步骤进行检测。反应液在使用前要彻底融化。分装反应液时,应尽量避免产生气泡。上机前注意检查各反应管是否盖紧,以免交叉污染。阳性对照在吸取前应瞬时离心后使用。
(2)本试剂盒需-20℃保存,并在有效期内使用。试剂盒中各组分应避免反复冻融。
(3)鉴于ASFV为一类检疫性疫病,上述操作应在相关生物安全设施内进行。对样品及其废弃物的操作应严格遵守生物安全规定。
(4)扩增完的PCR管切勿打开,以防污染。
(5)本试剂盒仅供兽医诊断使用。
【规格】 48 检测/盒
【贮藏与有效期】 -20℃保存,有效期为12个月。
【批准文号】
【生产企业】
仅供兽医诊断使用
(二)非洲猪瘟病毒荧光等温扩增检测试剂盒内包装标签
非洲猪瘟病毒荧光等温扩增检测试剂盒
兽用
48检测/盒 批准文号:
批 号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃保存,有效期为12个月。
【生产企业】
仅供兽医诊断使用
荧光等温扩增反应液
兽用
1100μl/管 批准文号:
批 号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃保存,有效期为12个月。
【生产企业】
仅供兽医诊断使用
Bst DNA 聚合酶
兽用
50μl/管 批准文号:
批 号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃保存,有效期为12个月。
【生产企业】
仅供兽医诊断使用
矿物油
兽用
1000μl/管 批准文号:
批 号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃保存,有效期为12个月。
【生产企业】
仅供兽医诊断使用
阳性对照
兽用
200μl/管批准文号:
批 号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃保存,有效期为12个月。
【生产企业】
仅供兽医诊断使用
阴性对照
兽用
1000μl/管批准文号:
批 号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃,有效期为12个月。
【生产企业】
仅供兽医诊断使用
三、非洲猪瘟病毒荧光PCR检测试剂盒说明书和内包装标签
(一)非洲猪瘟病毒荧光PCR检测试剂盒说明书
兽用
【兽药名称】
通用名 非洲猪瘟病毒荧光PCR检测试剂盒
商品名
英文名 African Swine Fever Virus Real Time PCR Detection Kit
汉语拼音 Feizhouzhuwen Bingdu Yingguang PCR Jiance Shijihe
【主要成分与含量】
|
组分 |
数量 |
|
消化液 |
1瓶(11ml) |
|
DNA结合液 |
1瓶(11ml) |
|
DNA洗涤液 |
1瓶(52ml) |
|
DNA洗脱液 |
1瓶(4ml) |
|
蛋白酶K |
1管(1.1ml) |
|
无菌无核酸酶水 |
1管(600µl) |
|
PCR扩增反应液 |
1管(600µl) |
|
实时荧光混合液 |
1管(155µl) |
|
阳性对照 |
1管(600µl) |
|
阴性对照 |
1管(600µl) |
|
DNA吸附柱和收集管 |
1袋(50套) |
【作用与用途】 用于猪全血、血清、脾脏、淋巴结、肌肉等组织样品及粪便样品中非洲猪瘟病毒DNA的检测。
【用法与判定】
1 用法
1.1 样品采集、保存及运输
1.1.1 样品采集
1.1.1.1 活猪样品 无菌采集EDTA抗凝血,或采血后按常规方法分离血清。
1.1.1.2 病死猪或屠宰猪样品 无菌采集脾脏、淋巴结、肌肉等组织样品。
1.1.1.3 病猪所处环境样品 采集粪便样品。
1.1.2 样品保存 所有待检样品在2~8℃保存应不超过24小时;在-20℃保存应不超过6个月;长期保存时,以-70℃以下为宜。
1.1.3 样品运输 样品一定要放置在有干冰或冰块的冷藏包中,保持全程冷链运输。要求在运输至实验室时,干冰仍覆盖标本或冰块仍未完全融化。
1.2 样品处理
1.2.1 抗凝血和血清处理 取抗凝血或血清200µl,置1.5ml灭菌离心管中。
1.2.2 组织样品处理 分别从待检组织三个不同的部位称取样品约1g,用手术剪剪碎混匀,再取0.05g于研磨器中研磨,加入1.5ml生理盐水继续研磨,待匀浆后转至1.5ml灭菌离心管中,8000r/min离心2分钟,取上清液200µl,置1.5ml灭菌离心管中。
1.2.3 粪便样品处理 取0.3g样品于研磨器中研磨,加入1.5ml生理盐水继续研磨,待匀浆后转至1.5ml灭菌离心管中,8000r/min离心2分钟,取上清液200µl,置1.5ml灭菌离心管中。
1.2.4 阳性对照处理 取阳性对照200µl,置1.5ml灭菌离心管中。
1.2.5 阴性对照处理 取阴性对照200µl,置1.5ml灭菌离心管中。
1.3 病毒DNA的提取
1.3.1 取已处理的样品、阴性对照和阳性对照,分别加入200µl消化液和20µl蛋白酶K,振荡混匀后,置56℃水浴中消化,每5分钟涡旋振荡一次,共消化15分钟。
1.3.2 从水浴锅中取出样品管,降至室温后,加入200μl DNA结合液,颠倒混匀,将全部液体移入吸附柱中(吸附柱要套上收集管,吸取液体时尽量不要吸到悬浮杂质,以免离心时堵塞吸附柱),室温静置3分钟,10000r/min离心30秒。
1.3.3 弃去收集管中液体,加入500μl DNA洗涤液,10000r/min离心30秒。
1.3.4 重复步骤1.3.3。
1.3.5 弃去收集管中液体,10000r/min空柱离心1分钟,以除去残留的DNA洗涤液。
1.3.6 将吸附柱放入新的1.5ml离心管中,向柱中央加入DNA洗脱液50μl,室温放置2分钟,10000r/min离心30秒,离心管中液体即为模板DNA。
1.4 实时荧光PCR操作
1.4.1 反应体系配制 设被检样品、阴性对照和阳性对照的份数总和为N,按如下反应体系配制:
|
无菌无核酸酶水 |
6.4×(N+1)µl |
|
PCR扩增反应液 |
10×(N+1)µl |
|
实时荧光混合液 |
2.6×(N+1)µl |
|
合计: |
19×(N+1)µl |
将以上配制的反应体系充分混匀后,分装至每个反应管中各19µl。分别取1.3.6中DNA 1µl,加入相应反应管中,盖紧管盖后5000r/min离心30秒。
1.4.2 扩增 将反应管放入荧光PCR仪内,记录样本摆放顺序。反应参数为95℃预变性2分钟;95℃变性5秒,58℃退火延伸15秒,共40个循环,荧光收集设置在每次循环的退火延伸结束时进行(报告基团“FAM”,淬灭基团“NONE”)。
2 判定
2.1 结果分析条件设定 阈值设定原则:阈值线超过阴性对照扩增曲线的最高点,且相交于阳性对照扩增曲线进入指数增长期的拐点,或根据仪器噪声情况进行调整。每个样品反应管内的荧光信号到达设定的阈值时所经历的循环数即为Ct值。
2.2 结果成立条件 阳性对照Ct值<30并出现特异的扩增曲线,阴性对照无Ct值且无特异的扩增曲线,试验结果成立。
2.3 结果判定
2.3.1 被检样品Ct值≤35并出现特异的扩增曲线,判为非洲猪瘟病毒核酸阳性。
2.3.2 被检样品无Ct值或Ct值≥40且无特异的扩增曲线,判为非洲猪瘟病毒核酸阴性。
2.3.3 被检样品35<Ct值<40并出现特异的扩增曲线,判为非洲猪瘟病毒核酸疑似,对疑似样品,需重新取样提取DNA,按双倍模板量(即2µl DNA)进行复检,Ct值<40并出现特异的扩增曲线判为阳性,否则判为阴性。
【注意事项】 (1)所有试剂应在规定的温度下保存。
(2)实验室应分配液区、模板提取区和扩增区。工作流程顺序为配液区→模板提取区→扩增区。各区器材试剂专用,不可跨区使用。实验结束后立即用1%次氯酸钠或75%酒精或紫外灯消毒工作台。
(3)PCR扩增反应液应置于冰盒上使用,其余冷冻保存的试剂使用前应室温融化,再8000r/min离心15秒,使液体全部沉于管底。用毕所有试剂立即放回原处。
(4)离心管、吸头等在实验前应全部高压灭菌。用灭菌的镊子夹取离心管,打开和盖上离心管盖时避免手和手套接触离心管口,若离心管开盖时有液体粘在手上或溅出,应立即更换手套。
(5)提取的样品,短期内使用放置于2~8℃或冰上,长期应在-70℃以下保存,但仍以新鲜提取的样品效果最好。
(6)反应体系在特定配液区配制,配制和分装反应体系时应尽量避免产生气泡,上机前,5000r/min离心30秒,检查各反应管是否盖紧,以免荧光物质泄露污染仪器,整个实验过程应严格控制污染。
(7)严格遵守操作说明可以获得最好的结果。操作过程中移液、定时、转速等全部参数必须精确。
(8)注意防止试剂盒组分受污染。不要使用超过有效期限的试剂,不同批次试剂盒之间的组分不要混用。
(9)所有用于检测的废弃物品均应放入含消毒液的废物缸内,高压灭菌处理。
【规格】 50份/盒
【贮藏与有效期】 蛋白酶K、无菌无核酸酶水、PCR扩增反应液、实时荧光混合液、阳性对照和阴性对照-20℃以下保存,其他组分室温保存,有效期为9个月。
【批准文号】
【生产企业】
仅供兽医诊断使用
(二)非洲猪瘟病毒荧光PCR检测试剂盒内包装标签
兽用
非洲猪瘟病毒荧光PCR检测试剂盒
50份/盒 批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 蛋白酶K、无菌无核酸酶水、PCR扩增反应液、实时荧光混合液、阳性对照和阴性对照-20℃以下保存,其他组分室温保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
消化液
11ml/瓶批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 室温保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
DNA结合液
11ml/瓶批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 室温保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
DNA洗涤液
52ml/瓶批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 室温保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
DNA洗脱液
4ml/瓶批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 室温保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
蛋白酶K
1.1ml/管批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃以下保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
无菌无核酸酶水
600µl/管批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃以下保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
PCR扩增反应液
600µl/管批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃以下保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
实时荧光混合液
155µl/管批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃以下保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
阳性对照
600µl/管批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃以下保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
阴性对照
600µl/管批准文号:
批号:
有效期至:
【用法与判定】 详见说明书。
【贮藏与有效期】 -20℃以下保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
兽用
DNA吸附柱和收集管
50套/袋批准文号:
批号:
有效期至:
【用法与用量】 详见说明书。
【贮藏与有效期】 室温保存,有效期为9个月。
【生产企业】
仅供兽医诊断使用
四、鳜传染性脾肾坏死病灭活疫苗(NH0618株)说明书和内包装标签
(一)鳜传染性脾肾坏死病灭活疫苗(NH0618株)说明书
兽用
【兽药名称】
通用名 鳜传染性脾肾坏死病灭活疫苗(NH0618株)
商品名 无
英文名 Mandarin Infectious Spleen and Kidney Necrosis Vaccine, Inactivated(Strain NH0618)
汉语拼音 Gui Chuanranxingpishenhuaisibing Miehuoyimiao(NH0618 Zhu)
【主要成分与含量】 疫苗含灭活的传染性脾肾坏死病毒(NH0618株),每毫升疫苗中灭活前病毒含量为106.5TCID50。
【性状】 乳白色均匀乳剂。
【作用与用途】 用于预防鳜传染性脾肾坏死病。免疫期为6个月。
【用法与用量】 腹腔注射。20g以上的鳜每尾注射0.1ml。
【不良反应】 一般无可见的不良反应。
【注意事项】 (1)仅用于接种健康鳜。
(2)疫苗贮藏及运输过程中切勿冻结,启封后应在4小时内用完,长时间暴露在高温下会影响疫苗效力,使用前使疫苗恢复至室温并充分摇匀。
(3)使用前应仔细检查包装,如发现破损、残缺、文字模糊、过期失效等,则禁止使用。
(4)禁止与其他疫苗合用。
(5)疫苗使用前,鱼应停止喂饲24小时。注射接种时,建议戴上棉布手套抓鱼并轻拿轻放,尽量避免因操作不当造成鱼的损伤。接种时应避开阴雨闷热天气,以防止供氧不足造成鱼的死亡。
(6)应使用无菌的注射器。
(7)如意外将疫苗污染到人的眼、鼻、口中或注射到人体内时,应及时对患部采取消毒等措施。必要时,请医疗人员予以治疗。
(8)用过的疫苗瓶、器具和未用完的疫苗等应进行无害化处理。
【规格】 (1)20ml/瓶 (2)50ml/瓶 (3)100ml/瓶 (4)250ml/瓶 (5)500ml/瓶
【包装】 (1)20 ml/瓶×10瓶/盒×30盒/箱 (2)50ml/瓶×100瓶/箱 (3)100 ml/瓶×50瓶/箱 (4)250 ml/瓶×20瓶/箱 (5)500 ml/瓶×10瓶/箱
【贮藏与有效期】 2~8℃保存,有效期为12个月。
【批准文号】
【生产企业】
仅在兽医指导下使用
(二)鳜传染性脾肾坏死病灭活疫苗(NH0618株)内包装标签
兽用
鳜传染性脾肾坏死病灭活疫苗(NH0618株)
20(50、100、250、500)ml/瓶批准文号:
批号:
有效期至:
【作用与用途】 用于预防鳜传染性脾肾坏死病。免疫期为6个月。
【用法与用量】 腹腔注射。20g以上的鳜每尾注射0.1ml。
【贮藏与有效期】 2~8℃保存,有效期为12个月。
【生产企业】
仅在兽医指导下使用
五、七味消滞颗粒说明书和标签
(一)七味消滞颗粒说明书
兽用
【兽药名称】
通用名称:七味消滞颗粒
商品名称:
汉语拼音:Qiwei Xiaozhi Keli
【主要成分】 薏苡仁、稻芽、山楂、淡竹叶、钩藤、蝉蜕、甘草。
【性状】 本品为黄棕色至红棕色的颗粒;气微,味甜、微苦。
【功能与主治】 开胃消滞,清热定惊。主治仔猪积滞化热。证见少食懒动,鼻盘干燥,粪便酸臭或燥结等。
【用法与用量】 混饲:每1kg饲料,仔猪4g,连用 3日。
【不良反应】 暂未发现不良反应。
【注意事项】
【规格】 每1g相当于原生药3.461g。
【包装】 100g/袋,聚乙烯药品包装用复合膜袋。
【贮藏】 密封。
【有效期】 24个月。
【批准文号】
【生产企业】
(二)七味消滞颗粒标签
兽用
【兽药名称】
通用名称:七味消滞颗粒
商品名称:
汉语拼音:Qiwei Xiaozhi Keli
【主要成分】 薏苡仁、稻芽、山楂、淡竹叶、钩藤、蝉蜕、甘草。
【性状】 本品为黄棕色至红棕色的颗粒;气微,味甜、微苦。
【功能与主治】 开胃消滞,清热定惊。主治仔猪积滞化热。证见少食懒动,鼻盘干燥,粪便酸臭或燥结等。
【用法与用量】 混饲:每1kg饲料,仔猪4g,连用 3日。
【规格】 每1g相当于原生药3.461g。
【批准文号】
【生产日期】
【生产批号】
【有效期】至
【贮藏】 密封。
【包装】 100g/袋,聚乙烯药品包装用复合膜袋。
【生产企业】
六、复方过硫酸氢钾枸橼酸粉说明书和标签
(一)复方过硫酸氢钾枸橼酸粉说明书
兽用外用
【兽药名称】
通用名称:复方过硫酸氢钾枸橼酸粉
商品名称:
英文名称:Compound Potassium Peroxymonosulphate and Citric Acid Powder
汉语拼音:Fufang Guoliusuanqingjia Juyuansuan Fen
【主要成分】 过硫酸氢钾复合盐、枸橼酸
【性状】本品为淡粉红色至淡紫红色粉末或颗粒,有柠檬气味。
【药理作用】 消毒防腐药。过硫酸氢钾复合盐在水中经链式反应可连续持久地产生小分子自由基、次氯酸、新生态氧和活性氧衍生物,氧化和氯化病原体,使病原体蛋白质变性凝固,增加细胞膜的通透性,造成酶和营养物质流失、病原体溶解破裂,从而杀灭病原微生物。枸橼酸影响病原微生物的酶反应和物质转运过程,使病原微生物能量耗尽而死亡。另外,枸橼酸能降低pH值,从而抑制病原微生物的生长,同时增强过硫酸氢钾复合盐的氧化作用,起到协同增效的效果。
【用途】 用于畜禽厩舍、空气和饮用水等的消毒。
【用法与用量】 以本品计。浸泡或喷雾:畜舍环境消毒、空气消毒,1︰200倍稀释;饮用水消毒,1︰1000倍稀释;对特定病原体消毒,大肠杆菌1︰400倍稀释,禽流感病毒1︰3200倍稀释,新城疫病毒1︰6400倍稀释,猪瘟病毒、猪蓝耳病病毒1︰800倍稀释。
【不良反应】 按推荐的用法与用量使用,未见不良反应。
【注意事项】 1. 现配现用。
2. 不与碱类物质混存或合并使用。
3. 产品用尽后,包装不得乱丢弃。
【休药期】 不需要制定。
【规格】 枸橼酸15.0%,含有效氯不得少于10.0%。
【包装】
【贮藏】 密闭,在干燥处保存。
【有效期】 24个月。
【批准文号】
【生产企业】
(二)复方过硫酸氢钾枸橼酸粉标签
兽用外用
【兽药名称】
通用名称:复方过硫酸氢钾枸橼酸粉
商品名称:
英文名称:Compound Potassium Peroxymonosulphate and Citric Acid Powder
汉语拼音:Fufang Guoliusuanqingjia Juyuansuan Fen
【主要成分】 过硫酸氢钾复合盐、枸橼酸
【性状】 本品为淡粉红色至淡紫红色粉末或颗粒,有柠檬气味。
【用途】 用于畜禽厩舍、空气和饮用水等的消毒。
【用法与用量】 以本品计。浸泡或喷雾:畜舍环境消毒、空气消毒,1︰200倍稀释;饮用水消毒,1︰1000倍稀释;对特定病原体消毒,大肠杆菌1︰400倍稀释,禽流感病毒1︰3200倍稀释,新城疫病毒1︰6400倍稀释,猪瘟病毒、猪蓝耳病病毒1︰800倍稀释。
【规格】 枸橼酸15.0%,含有效氯不得少于10.0%。
【批准文号】
【生产日期】
【生产批号】
【有效期】至
【休药期】 不需要制定。
【贮藏】 密闭,在干燥处保存。
【包装】
【生产企业】
七、氨基丁三醇前腺素F2α注射液说明书和标签
(一)氨基丁三醇前腺素F2α注射液说明书
兽用
【兽药名称】
通用名称:氨基丁三醇前列腺素F2α注射液
商品名称:谛诺
英文名称:Prostaglandin F2α Tromethamine Injection
汉语拼音:Anji Dingsanchun Qianliexiansu F2α Zhusheye
【主要成分】 氨基丁三醇前列腺素F2α。
【性状】 本品为无色的澄明液体。
【药理作用】 氨基丁三醇前列腺素F2α又名地诺前列腺素,也被称为黄体溶解素。本品能溶解黄体,使孕酮产生减少或停止,结果使黄体期缩短,使母畜提早发情和排卵,有利于配种、人工同期输精或胚胎移植。对于卵巢黄体囊肿或持久性黄体,本品均可使黄体萎缩退化,促进发情和排卵;前列腺素F2α能兴奋子宫平滑肌,对妊娠和未妊娠的子宫都有作用,妊娠末期的子宫对本品尤为敏感,可使子宫张力增加,子宫颈松弛,适用于催产、引产和人工流产。
【适应证】 主要用于控制母牛同期发情。
【用法与用量】 以前列腺素F2α计。肌内注射:一次量,牛25mg(5ml)。
【不良反应】 按推荐剂量使用未见不良反应发生。
【注意事项】 1.避免怀孕妇女接触药液,禁止患气管、支气管或其他呼吸道疾病患者或怀孕妇女对动物注射本品。
2.本品滴在皮肤上,应立即用肥皂和水清洗。
3.患急性或亚急性血管、胃肠道及呼吸系统疾病的动物禁用。
4.本品能导致多种动物流产或诱导分娩,注射本品前必须确定妊娠状态。
5.排卵后五天内给药无效。
6.禁止静脉注射。
【休药期】 牛1日。
【规格】 (1)10ml∶前列腺素F2α 50mg (2)20ml∶前列腺素F2α 100mg (3)50ml∶前列腺素F2α 250mg
【包装】 安瓿瓶、西林瓶
【贮藏】 密闭,在凉暗处保存。
【有效期】 24个月。开启后24小时内有效。
【批准文号】
【生产企业】 宁波三生生物科技有限公司。
(二)氨基丁三醇前腺素F2α注射液标签
兽用
【兽药名称】
通用名称:氨基丁三醇前列腺素F2α注射液
商品名称:谛诺
英文名称:Prostaglandin F2α Tromethamine Injection
汉语拼音:Anji Dingsanchun Qianliexiansu F2α Zhusheye
【主要成分】 氨基丁三醇前列腺素F2α。
【性状】 本品为无色的澄明液体。
【适应证】 有溶解黄体作用,主要用于控制母牛同期发情。
【用法与用量】 以前列腺素F2α计。肌内注射:一次量,牛25mg(5ml)。
【规格】 (1)10ml∶前列腺素F2α 50mg (2)20ml∶前列腺素F2α 100mg (3)50ml∶前列腺素F2α 250mg
【批准文号】
【生产日期】
【生产批号】
【有效期】 至
【休药期】 牛1日。
【贮藏】 密闭,在凉暗处保存。
【包装】 安瓿瓶、西林瓶
【生产企业】 宁波三生生物科技有限公司。
八、维他昔布咀嚼片说明书和标签
(一)维他昔布咀嚼片说明书
宠物用
【兽药名称】
通用名称:维他昔布咀嚼片
商品名称:贝安可
英文名称:Vitacoxib Chewable Tablets
汉语拼音:Weitaxibu Jujuepian
【主要成分】 维他昔布
【性状】 本品为白色刻痕片。
【药理作用】 解热镇痛抗炎药。
药效学 维他昔布是非甾体类抗炎药(NSAIDs)中的选择性环氧酶-2抑制剂。环氧酶有环氧酶-1(COX-1)和环氧酶-2(COX-2)两种亚型。环氧酶-1负责维持基本的生理过程(例如血小板凝聚、胃黏膜保护、肾灌注),环氧酶-2负责合成炎性介质。NSAIDs的抗炎镇痛作用与抑制COX-2的活性有关,而胃肠道及血液系统等不良反应与抑制COX-1的活性有关。维他昔布通过选择性抑制COX-2来阻断花生四烯酸合成前列腺素而发挥作用。犬体外全血试验结果表明,维他昔布对COX-2活性抑制的IC50为0.34μg·ml-1,对COX-1活性抑制的IC50为19.40μg·ml-1,对COX-2的活性抑制具有选择性(IC50COX-1与IC50COX-2比值为56.96)。在治疗浓度下维他昔布对COX-1没有抑制作用,因此,胃肠道不良反应发生率明显减少。
药动学 比格犬单次饲喂食物前内服30mg规格的维他昔布咀嚼片(相当于2.5mg/kg体重),血浆消除半衰期(t1/2)为5.87h;血浆清除率(CL)为5.12L·kg-1·h-1;表观分布容积(V)为53.89L·kg-1;血药浓度时间曲线下面积(AUClast)为625.88ng·h·ml-1。比格犬单次饲喂食物后内服30mg规格的维他昔布咀嚼片,消除半衰期(t1/2)为3.32h;血浆清除率(CL)为1.20L·kg-1·h-1;表观分布容积(V)为5.49L·kg-1;血药浓度时间曲线下面积(AUClast)为2639.66ng·h·mL-1。维他昔布饲喂食物后给药的AUC是禁食给药状态下的4.2倍,因此建议饲喂食物后给药。比格犬连续7日给药在体内药物量无明显增加和减少,无药物蓄积和肝药酶诱导作用。
比格犬内服本品后约2~3小时达最高血药浓度,绝对生物利用度为59.11%。本品主要经肝脏代谢,主要代谢产物为羧基代谢物。主通过粪便和尿液排泄。
【适应证】 用于治疗犬围手术期及临床手术等引起的炎症和疼痛。
【用法与用量】 以维他昔布计。内服:每1kg体重,犬2mg,每日一次。建议饲喂食物后给药,术前及术后可连续给药7日。具体推荐使用剂量见下表:
|
犬体重(kg) |
8mg片 |
20mg片 |
30mg片 |
|||
|
片数 |
剂量(mg) |
片数 |
剂量(mg) |
片数 |
剂量(mg) |
|
|
>2~2.5 |
0.5 |
4 |
|
|
|
|
|
>2.5~4 |
1 |
8 |
|
|
|
|
|
>4~6 |
1.5 |
12 |
|
|
|
|
|
>6~8 |
2 |
16 |
|
|
|
|
|
>5~10 |
|
|
1 |
20 |
|
|
|
>10~15 |
|
|
1.5 |
30 |
|
|
|
>15~20 |
|
|
2 |
40 |
|
|
|
>4~7.5 |
|
|
|
|
0.5 |
15 |
|
>7.5~15 |
|
|
|
|
1 |
30 |
|
>15~22.5 |
|
|
|
|
1.5 |
45 |
|
>22.5~30 |
|
|
|
|
2 |
60 |
|
>30~37.5 |
|
|
|
|
2.5 |
75 |
|
>37.5~45 |
|
|
|
|
3 |
90 |
【不良反应】 按推荐的用法用量使用,尚未见不良反应。
【注意事项】 1.对本品活性成分维他昔布有过敏史的动物禁用。
2.由于非甾体类抗炎药(NSAIDs)具有潜在发生胃溃疡和/或穿孔的风险,因此在使用本品时应当避免使用其它抗炎类药物,如NSAIDs或皮质类固醇类药。
3.本品对患有胃肠道出血、血液病或其它出血性疾病的犬禁用。
4.如果患病犬之前对NSAIDs不耐受,应在兽医的严格监测下使用本品。如果观察到下列症状应停止用药:反复腹泻、呕吐、粪便隐血、体重突然下降、厌食、嗜睡、肾或肝功能退化。
5.繁殖、妊娠或泌乳雌犬,幼犬(例如10周龄以下或体重小于4公斤的犬)或疑似和确诊有肾、心脏或肝功能损害的犬,应在兽医的指导下使用。
6.宠物主人应该警惕诸如厌食、精神萎靡、无力等症状和体征,而且当有上述任何症状或体征发生后应该马上寻求兽医帮助。
【休药期】 无需制定
【规格】 (1)8mg (2)20mg (3)30mg
【包装】
【贮藏】 密封,干燥保存。
【有效期】 36个月。
【批准文号】
【生产企业】
宠物用
【兽药名称】
通用名称:维他昔布咀嚼片
商品名称:贝安可
英文名称:Vitacoxib Chewable Tablets
汉语拼音:Weitaxibu Jujuepian
【主要成分】 维他昔布
【性状】 本品为白色刻痕片。
【药理作用】 解热镇痛抗炎药。
药效学 维他昔布是非甾体类抗炎药(NSAIDs)中的选择性环氧酶-2抑制剂。环氧酶有环氧酶-1(COX-1)和环氧酶-2(COX-2)两种亚型。环氧酶-1负责维持基本的生理过程(例如血小板凝聚、胃黏膜保护、肾灌注),环氧酶-2负责合成炎性介质。NSAIDs的抗炎镇痛作用与抑制COX-2的活性有关,而胃肠道及血液系统等不良反应与抑制COX-1的活性有关。维他昔布通过选择性抑制COX-2来阻断花生四烯酸合成前列腺素而发挥作用。
药动学 猫单次饲喂食物前内服8mg规格的维他昔布咀嚼片(相当于1mg/kg体重),血浆消除半衰期(t1/2)为6.03h;血药浓度时间曲线下面积(AUClast)为4521.67ng·h·mL-1;峰浓度(Cmax)为340.64ng·mL-1。猫内服本品后约4~5小时达最高血药浓度,绝对生物利用度为51%。猫连续7日给药在体内药物量无明显增加和减少,无药物蓄积和肝药酶诱导作用。
【适应证】 用于治疗猫围手术期及临床手术等引起的疼痛和炎症。
【用法与用量】 以维他昔布计。内服,每1kg体重,猫1mg,每日一次。术前及术后可连续给药3日。具体推荐使用剂量见下表:
|
猫体重(kg) |
给药剂量 |
|
|
片数 |
剂量(mg) |
|
|
>2~4 |
0.5 |
4 |
|
>4~8 |
1 |
8 |
|
>8~12 |
1.5 |
12 |
【不良反应】 按推荐的用法用量使用,尚未见不良反应。
【注意事项】 1.对本品活性成分维他昔布有过敏史的动物禁用。
2.由于非甾体类抗炎药(NSAIDs)具有潜在发生胃溃疡和/或穿孔的风险,因此在使用本品时应当避免使用其它抗炎类药物,如NSAIDs或皮质类固醇类药。
3.本品对患有胃肠道出血、血液病或其它出血性疾病的猫禁用。
4.如果患病猫之前对NSAIDs不耐受,应在兽医的严格监测下使用本品。如果观察到下列症状应停止用药:反复腹泻、呕吐、粪便隐血、体重突然下降、厌食、嗜睡、肾或肝功能退化。
5.繁殖、妊娠或泌乳雌猫,幼猫(例如6周龄以下或体重小于2公斤的猫)或疑似和确诊有肾、心脏或肝功能损害的猫,应在兽医的指导下使用。
6.宠物主人应该警惕诸如厌食、精神萎靡、无力等症状和体征,而且当有上述任何症状或体征发生后应该马上寻求兽医帮助。
【休药期】 无需制定。
【规格】 8mg
【包装】
【贮藏】 密封,干燥保存。
【有效期】 36个月。
【批准文号】
【生产企业】
(二)维他昔布咀嚼片标签
维他昔布咀嚼片内标签
宠物用
【兽药名称】 维他昔布咀嚼片
【适应证】 用于治疗犬围手术期及临床手术等引起的炎症和疼痛。
【规格】 (1)8mg (2)20mg (3)30mg
【生产批号】
【生产企业】
维他昔布咀嚼片标签
宠物用
【兽药名称】
通用名称:维他昔布咀嚼片
商品名称:贝安可
英文名称:Vitacoxib Chewable Tablets
汉语拼音:Weitaxibu Jujuepian
【主要成分】 维他昔布
【性状】 本品为白色刻痕片。
【适应证】 用于治疗犬围手术期及临床手术等引起的炎症和疼痛。
【用法与用量】 以维他昔布计。内服:每1kg体重,犬2mg,每日一次。建议饲喂食物后给药,术前及术后可连续给药7日(详见说明书)。
【规格】 (1)8mg (2)20mg (3)30mg
【批准文号】
【生产日期】
【生产批号】
【有效期】 至
【休药期】 无需制定
【贮藏】 密封,干燥保存。
【包装】
【生产企业】
维他昔布咀嚼片内标签
宠物用
【兽药名称】 维他昔布咀嚼片
【适应证】 用于治疗猫围手术期及临床手术等引起的炎症和疼痛。
【规格】 8mg
【生产批号】
【生产企业】
维他昔布咀嚼片标签
宠物用
【兽药名称】
通用名称:维他昔布咀嚼片
商品名称:贝安可
英文名称:Vitacoxib Chewable Tablets
汉语拼音:Weitaxibu Jujuepian
【主要成分】 维他昔布
【性状】 本品为白色刻痕片。
【适应证】 用于治疗猫围手术期及临床手术等引起的炎症和疼痛。
【用法与用量】 以维他昔布计。内服:每1kg体重,猫1mg,每日一次。术前及术后可连续给药3日(详见说明书)。
【规格】 8mg
【批准文号】
【生产日期】
【生产批号】
【有效期】至
【休药期】 无需制定。
【贮藏】 密封,干燥保存。
【包装】
【生产企业】
相关新闻
- 中华人民共和国农业农村部公告第362号 2021-01-29
- 中华人民共和国农业农村部公告第363号 2021-01-29
- 中华人民共和国农业农村部公告第365号 2021-01-29
- 中华人民共和国农业农村部公告第312号 2020-10-15
- 中华人民共和国农业农村部公告 第173号 2019-06-20



 提示信息
提示信息